
关于下列各装置图的叙述中,不正确的是
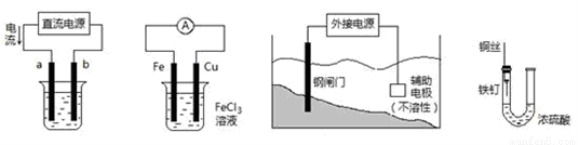
① ② ③ ④
A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B.装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+
C.装置③中钢闸门应与外接电源的负极相连
D.装置④中的铁钉几乎没被腐蚀
 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源:2015届江西省高三上学期第一学期月考化学试卷(解析版) 题型:选择题
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
选项 | 叙述I | 叙述II |
A | SiO2可与HF反应 | 氢氟酸不能保存在玻璃瓶中 |
B | Fe3+具有氧化性 | 用KSCN溶液可以鉴别Fe3+ |
C | 溶解度:CaCO3<Ca(HCO3)2 | 溶解度:Na2CO3<NaHCO3 |
D | NH4Cl为强酸弱碱盐 | 加热可除去NaCl中的NH4Cl |
查看答案和解析>>
科目:高中化学 来源:2015届江苏省苏州市高三9月学情调研化学试卷(解析版) 题型:选择题
一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中不正确的是
| 甲 | 乙 | 丙 | 丁 | |
密闭容器体积/L | 2 | 2 | 2 | 2 | |
起始物质的量 | n(SO2)/mol | 0.40 | 0.80 | 0.80 | 0.40 |
n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
SO2的平衡转化率% | 80 |
|
|
| |
A.甲中反应的平衡常数小于乙B.该温度下,该反应的平衡常数K为400
C.SO2的平衡转化率: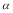 1<
1<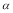 2 =
2 = 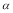 3 D.容器中SO3的物质的量浓度:丙=丁<甲
3 D.容器中SO3的物质的量浓度:丙=丁<甲
查看答案和解析>>
科目:高中化学 来源:2015届江苏省淮安市协作体高二下学期期中考试化学试卷(解析版) 题型:填空题
已知: C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ΔH=+141 kJ/mol
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g) ΔH= 。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省淮安市协作体高二下学期期中考试化学试卷(解析版) 题型:选择题
COCl2(g) CO(g)+Cl2(g) △H>0 当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
CO(g)+Cl2(g) △H>0 当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
A.①②④ B.①④⑥ C.②③⑥ D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源:2015届江苏省淮安市协作体高二下学期期中考试化学试卷(解析版) 题型:选择题
下物质分类组合正确的是
| A | B | C | D |
强电解质 | HCl | FeCl3 | H3PO4 | HClO |
弱电解质 | HF | CH3COOH | BaSO4 | Ba(OH)2 |
非电解质 | NH3 | Cu | H2O | C2H5OH |
查看答案和解析>>
科目:高中化学 来源:2015届江苏省淮安市协作体高二下学期期中考试化学试卷(解析版) 题型:选择题
已知反应2CO(g)=2C(s)+O2(g)的△H为正值,△S为负值。设△H和△S不随温度而变,下列说法正确的是
A、低温下能自发进行
B、高温下能自发进行
C、低温下不能自发进行,高温下能自发进行
D、任何温度下都不能自发进行
查看答案和解析>>
科目:高中化学 来源:2015届江苏省沭阳县高二下学期期中调研测试化学试卷(解析版) 题型:选择题
央视“315特别行动”曝光了河南一些地方“瘦肉精”事件。“瘦肉精”对人体健康会产生危害。已知某种“瘦肉精”含有克伦特罗(Clenbuterol),其结构如下图。下列有关克伦特罗的叙述,正确的是
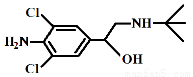
A.该物质的分子式为C12H17ON2Cl
B.该物质不溶于盐酸
C.该物质能与FeCl3溶液发生显色反应
D.该物质分子间都可以形成氢键
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高二下学期4月阶段测试化学试卷(解析版) 题型:选择题
一定温度下,在4个容积均为1 L的恒容容器中分别进行反应(各容器中A都足量)A(s)+B(g) C(g)+D(g) ΔH =+100 kJ·mol-1,某时刻测得部分数据如下表:
C(g)+D(g) ΔH =+100 kJ·mol-1,某时刻测得部分数据如下表:
容器编号 | n(B)/mol | n(C)/mol | n(D)/mol | 反应时间/min | 反应速率 |
Ⅰ | 0.06 | 0.60 | 0.10 | t1 | v(正)=v(逆) |
Ⅱ | 0.12 | 1.20 | 0.20 | t2 |
|
Ⅲ | 0.32 | 1.0 | 0 | 0 |
|
Ⅳ | 0.12 | 0.30 |
|
| v(正)=v(逆) |
下列说法正确的是
A.容器Ⅰ中平均反应速率v(B)=0.04/t1 mol·L-1·min-1
B.t2时容器Ⅱ中v(正)>v(逆)
C.容器Ⅲ中反应至平衡时吸热20 kJ
D.容器Ⅳ中c(D)= 0.4 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com