
���� ��1��1��20��Ԫ����Li��Na��K��Ca��Al��Be��Mg��7�ֽ���Ԫ�أ���������ǿ��ΪK���غ���Ԫ�����γ������ء��������صȻ����
��2��̼Ԫ���γ��л���γɵ�����������ࣻ
��3��ͬ�����������ԭ�Ӱ뾶��С��
��4��ͬ����Ԫ�صķǽ���������ԭ���������������ǿ��ͬ�������϶���Ԫ�صķǽ����Լ�����Ԫ�صķǽ�����Խǿ�����⻯��Խ�ȶ���
��5��ͬ���ڴ����ҵ縺��������ͬ������ϵ��µ縺����С��
��6��p��������6�����ӣ����p�����������p�������3�����ӣ�Ϊ��VA��Ԫ�أ�
��� �⣺��1��1��20��Ԫ����Li��Na��K��Ca��Al��Be��Mg��7�ֽ���Ԫ�أ���������ǿ��ΪK��K��O2��������K2O��K2O2�ȣ�
�ʴ�Ϊ��7��K2O��K2O2��
��2��̼Ԫ���γ��л���γɵ�����������࣬�ʴ�Ϊ��C��
��3��ͬ�����������ԭ�Ӱ뾶��С���ʵ��������а뾶����Ԫ����Na���ʴ�Ϊ��Na��
��4������N�ķǽ����Ա�Siǿ�����NH3��SiH4�ȶ����ʴ�Ϊ��NH3��SiH4��
��5��ͬ���ڴ����ҵ縺��������ͬ������ϵ��µ縺����С���ʵ縺������Ԫ����F����С����K���ʴ�Ϊ��F��K��
��6��p��������6�����ӣ����p�����������p�������3�����ӣ�Ϊ��VA��Ԫ�أ�ԭ������С��20�ĵ�VA��Ԫ�طֱ���N��P���ʴ�Ϊ��N��P��
���� ���⿼��Ԫ�������ɺ�Ԫ�����ڱ�����������Ų��ȣ�ע��Ի���֪ʶ���������գ��ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| ���� | �۵�/�� | �е�/�� |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| �������� | Fe3+ | Fe2+ | Al3+ | Ni2+ |
| ��ʼ������pH | 1.1 | 5.8 | 3.0 | 6.8 |
| ��ȫ������pH | 3.2 | 8.8 | 5.0 | 9.5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
�� �������Ļ�ѧ������Ϊ���Ӽ������ۼ���
�������Ļ�ѧ������Ϊ���Ӽ������ۼ��� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | K2O��MgO��CaO | B�� | MgO��CaO��K2O | C�� | MgO��K2O��CaO | D�� | CaO��K2O��MgO |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
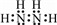 ��
�� ��N����sp3�ӻ���ʽ�����ӿռ乹��ΪV�ͣ�
��N����sp3�ӻ���ʽ�����ӿռ乹��ΪV�ͣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
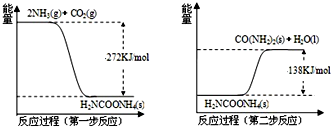
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com