
| A. | 氢是原子半径最小的元素 | |
| B. | 氟是非金属性最强的元素 | |
| C. | 硅元素适合作半导体材料 | |
| D. | 稀有气体元素原子的最外层电子数均为8 |
科目:高中化学 来源: 题型:选择题
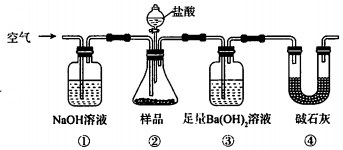
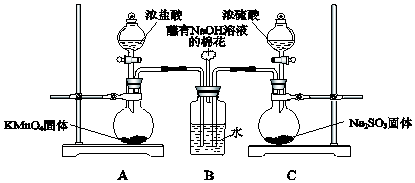
| A. | 必须在②③间添加吸收HCl的装置 | |
| B. | ④的作用是防止空气中的气体影响实验的精确度 | |
| C. | 通入空气的作用是保证②中产生的气体完全转移到③中 | |
| D. | 称取样品和③中产生的沉淀的质量即可求算Na2CO3固体的纯度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在18 g CD4中含有NA个碳原子 | |
| B. | 某无水乙醇与足量金属钠反应生成5.6LH2,该乙醇分子中共价键总数为4NA | |
| C. | 4.4g乙醛和丁酸的混合物完全燃烧,消耗氧分子的数目为0.25NA | |
| D. | 100mL浓度为lmol/L的蔗糖溶液中所含分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
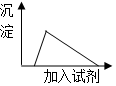
| A. | 该溶液中,Ag+、K+、NH4+、SO42-可以大量共存 | |
| B. | 该溶液中,Na+、OH-、NO3-、CO32-不能大量共存 | |
| C. | 向该溶液中逐滴加入AlCl3溶液,生成沉淀与加入AlCl3溶液关系如图 | |
| D. | 向该溶液中逐滴加入稀盐酸,生成沉淀与加入稀盐酸关系如图 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除零族元素外,短周期元素的最高化合价在数值上等于该元素所属的族序数 | |
| B. | ⅦA族元素其简单阴离子的核外电子层数等于该元素所在的周期数 | |
| C. | 除短周期外,其他周期均有18种元素 | |
| D. | X2+的核外电子数目为18,则X在第三周期第ⅡA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
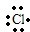 →
→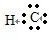
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解池,阳极Pt,阴极用Cu,纯水做电解液 | |
| B. | 原电池,负极用Cu,正极用石墨,氯化钠溶液做电解液 | |
| C. | 电解池,阳极用Cu,阴极用石墨,H2SO4做电解液 | |
| D. | 电解池,阳极用Cu,阴极用石墨,Na2SO4做电解液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com