


 ×100%,
×100%, =
=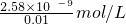 =2.58×10-7mol/L,
=2.58×10-7mol/L, ×100%;2.58×10-7mol/L;
×100%;2.58×10-7mol/L;

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:解答题
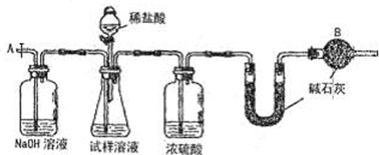
 根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示):
根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示):
 .核磁共振法能够区分这两种结构.在核磁共振氢谱中,正确的结构有______种峰(即有几种化学环境完全相同H原子),错误的结构有______种峰.
.核磁共振法能够区分这两种结构.在核磁共振氢谱中,正确的结构有______种峰(即有几种化学环境完全相同H原子),错误的结构有______种峰.查看答案和解析>>
科目:高中化学 来源: 题型:单选题
 2Fe+3CO2
2Fe+3CO2 4NO+6H2O
4NO+6H2O 2Fe2O3+8SO3
2Fe2O3+8SO3查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com