
| A. | 碳酸氢钠加热可以分解,因为升高温度利于熵增的方向自发进行 | |
| B. | 在温度、压强一定的条件下,自发反应总是向△G=△H-T△S<0的方向进行 | |
| C. | 水结冰的过程不能自发进行的原因是熵减的过程,改变条件也不可能自发进行 | |
| D. | 混乱度减小的吸热反应一定不能自发进行 |
 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:选择题
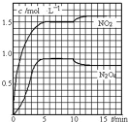 向2L 的密闭容器中充入7.6molNO和3.8mol O2,发生如下反应:①2NO(g)+O2(g)═2NO2(g)②2NO2(g)═N2O4(g)测得 NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min 后升高并维持容器的温度为T2℃.下列说法正确的是( )
向2L 的密闭容器中充入7.6molNO和3.8mol O2,发生如下反应:①2NO(g)+O2(g)═2NO2(g)②2NO2(g)═N2O4(g)测得 NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min 后升高并维持容器的温度为T2℃.下列说法正确的是( )| A. | 前 5min 反应的平均速率 v(N2O4)=0.36mol•L-1•min-1 | |
| B. | T1℃时反应②的化学平衡常数K=0.6 | |
| C. | 若起始时向该容器中充入3.6molNO 2和 2.0mol N2O4,T1℃达到平衡时,N2O4的转化率为10% | |
| D. | 反应①、②均为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加入氯化铵固体 | B. | 适当升高温度 | C. | 通入氨气 | D. | 加入少量浓盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业上生产硝酸的主要过程如下:
工业上生产硝酸的主要过程如下:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 沉淀转化反应2AgCl(s)+CO32-(aq)?Ag2CO3(s)+2Cl-(aq)的平衡常数为20mol•L-1 | |
| B. | 约有2×10-5mol AgCl溶解 | |
| C. | 反应后溶液中的:c(Na+)>c (Cl-)>c (CO32-)>c (OH-)>c (H+) | |
| D. | 反应后溶液中的:c(Na+)+c (H+)+c (Ag+)=2 c (CO32-)+c (HCO3-)+c (Cl-)+c (OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2(OH)2CO3═2CuO+H2O+CO2↑ | B. | Fe2O3+3H2SO4═Fe2(SO4)3+3H2O | ||
| C. | CO2+Ca(OH)2=CaCO3↓+H2O | D. | 2Al+Fe2O3═Al2O3+2Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4溶液中加入Ba(OH)2溶液后恰好显中性Ba2++OH-+H++SO42-═BaSO4+H2O | |
| B. | 向澄清石灰水中通入过量CO2:OH-+CO2═HCO3- | |
| C. | 氢氧化钡溶液与稀 H2SO4 反应:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com