

分析 金属A与氧气反应生成B,B与盐酸反应得到C与D,由C、D之间相互转化可知A为变价金属,可推知A为Fe,则B为Fe3O4,C为FeCl2,D为FeCl3,X为H2,E为Fe(OH)2,F为Fe(OH)3,G为Fe2O3,据此解答.
解答 解:金属A与氧气反应生成B,B与盐酸反应得到C与D,由C、D之间相互转化可知A为变价金属,可推知A为Fe,则B为Fe3O4,C为FeCl2,D为FeCl3,X为H2,E为Fe(OH)2,F为Fe(OH)3,G为Fe2O3.
(1)C的化学式为FeCl2,F的化学式为Fe(OH)3,故答案为:FeCl2;Fe(OH)3;
(2)检验FeCl3溶液中金属阳离子的实验操作及现象是:取少许D的溶液于试管中,加几滴KSCN溶液,溶液变红色,即证明含Fe3+,
故答案为:取少许D的溶液于试管中,加几滴KSCN溶液,溶液变红色,即证明含Fe3+;
(3)E生成F可观察到的现象:白色絮状沉淀迅速变成灰绿色,最后变成红褐色,化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:白色絮状沉淀迅速变成灰绿色,最后变成红褐色;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)B→C的离子方程式为:Fe3O4+8H+=Fe2+2Fe3++4H2O,
故答案为:Fe3O4+8H+=Fe2+2Fe3++4H2O.
点评 本题考查无机物的推断,关键根据C与D之间的相互转化判断金属A为变价金属,再结合转化关系推断,需要学生熟练掌握元素化合物知识,难度不大.


科目:高中化学 来源: 题型:选择题
| A、探究不同催化剂对同一反应速率的影响 | B、探究温度对化学平衡的影响 |
 试剂:淀粉溶液、碘水、 唾液、2mol/L H2SO4溶液 现象:图中左试管溶液颜色一段时间后逐渐变蓝色,右试管溶液颜色迅速变蓝色 | 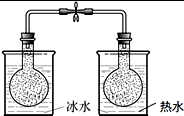 2NO2(g)?N2O4△H<0 试剂:烧瓶中各充入等质量的NO2 现象:一段时间后,右边烧瓶内气体颜色变浅,左边烧瓶内气体颜色变深 |
| C、探究醋酸、碳酸、硼酸的酸性强弱 | D、验证外加电流的阴极保护法 |
 试剂:0.1mol/L醋酸溶液、饱和硼酸 溶液0.1mol/L Na2CO3溶液 现象:图中左试管内液面产生气泡,右试管无明显现象 | 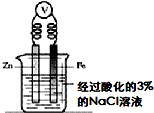 试剂:酸化的3%的NaCl溶液、 铁氰化钾溶液 现象:一段时间后,向烧杯中滴加2滴铁氰化钾溶液,不产生蓝色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| C | ||
| A | R | B |
| D |
| A. | 4Z | B. | 4Z+10 | C. | 4Z+14 | D. | 4Z+5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
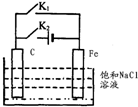
| A. | 断开 K2,闭合 K1时,Fe 电极反应为:2 H++2e-=H2↑ | |
| B. | 断开 K2,闭合 Kl 时,C电极反应为:2Cl--2e-=Cl2↑ | |
| C. | 断开 K1,闭合 K2时,Fe 电极反应为:Fe-2e-=Fe2+ | |
| D. | 断开 Kl,闭合 K2时,C电极反应为:2Cl--2e-=Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①是BaCl2溶液,②稀盐酸 | B. | ①是稀盐酸,②稀BaCl2溶液 | ||
| C. | ①是稀硝酸,②是AgNO3溶液 | D. | ①是稀硫酸,②是AgNO3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com