
【题目】一定条件下正丁烷(CH3CH2CH2CH3)易发生两种裂解反应:
Ⅰ.CH3CH2CH2CH3 (g)![]() CH3CH=CH2(g)+CH4(g) △H1=+ 61.31 kJ·mol-1
CH3CH=CH2(g)+CH4(g) △H1=+ 61.31 kJ·mol-1
Ⅱ.CH3CH2CH2CH3(g)![]() CH2=CH2(g)+CH3CH3(g) △H2=-56.00 kJ·mol-1
CH2=CH2(g)+CH3CH3(g) △H2=-56.00 kJ·mol-1
(1)维持体系温度T不变,总压p恒定时,体积为V1 L的正丁烷发生裂解反应,一段时间平衡后气体体积变为V2 L,此时正丁烷的转化率a(正丁烷)=________;维持体系温度不变,向体系中充入一定量的水蒸气(水蒸气在该条件下不参与反应),再次平衡后正丁烷的转化率将________(填“增大”、“不变”或“减小”),原因为____________________________________________________。
(2)一定温度下向体积为2L的密闭容器中充入0.2molCH3CH=CH2和0.5 molCH4发生反应CH3CH=CH2(g) +CH4(g)![]() CH2=CH2(g)+CH3CH3(g) △H3;5 min后达到平衡状态,容器内剩余CH3CH =CH2的物质的量为0.1mol。
CH2=CH2(g)+CH3CH3(g) △H3;5 min后达到平衡状态,容器内剩余CH3CH =CH2的物质的量为0.1mol。
①△H3=________。
②5min内该反应的反应速率v(CH4)=________。
③保持温度不变,向某密闭容器中充入等物质的量的CH3CH =CH2和CH4,平衡后容器内CH4的体积分数为________。
(3)将0.1molCH2=CH2完全燃烧后的气体通入100mL一定浓度的NaOH溶液中,并将所得溶液稀释至1L。最终所得溶液中CO32-、HCO3-、H2CO3 三者所占物质的量分数随原NaOH溶液浓度变化的关系如图所示:
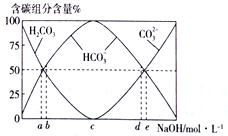
其中图中表示原氢氧化钠溶液浓度为3mol·L-1的是________(选填“a”、“b”、“c”、“d”或“e” ),
(4)以氢氧化钠溶液为电解质溶液,CH2=CH2 燃料电池的负极反应式为_________________。
【答案】 ![]() 增大 充入水蒸气扩大容器体积,所以平衡会向正向移动 -117.31kJ·mol-1 0.01mol·L-1·min-1 33.3% d CH2=CH2+16OH--12e-= 2CO32-+10H2O
增大 充入水蒸气扩大容器体积,所以平衡会向正向移动 -117.31kJ·mol-1 0.01mol·L-1·min-1 33.3% d CH2=CH2+16OH--12e-= 2CO32-+10H2O
【解析】(1). 在等温等压的条件下,气体的体积之比等于物质的量之比,根据方程式可得消耗的V(CH3CH2CH2CH3)=(V2-V1)L,此时正丁烷的转化率α(正丁烷)= (V2-V1)÷V1,维持体系温度不变,向体系中充入一定量的水蒸气(水蒸气在该条件下不参与反应),相当于增大容器的体积,平衡正向移动,再次平衡后正丁烷的转化率将增大,故答案为: ![]() ;增大;
;增大;
(2). ①. 已知Ⅰ.CH3CH2CH2CH3(g)![]() CH3CH=CH2(g)+CH4(g)△H1=+61.31kJ·mol-1
CH3CH=CH2(g)+CH4(g)△H1=+61.31kJ·mol-1
Ⅱ.CH3CH2CH2CH3(g)![]() CH2=CH2(g)+CH3CH3(g)△H2=-56.00kJ·mol-1
CH2=CH2(g)+CH3CH3(g)△H2=-56.00kJ·mol-1
根据盖斯定律可知,II-I得CH3CH=CH2(g)+CH4(g)![]() CH2=CH2(g)+CH3CH3(g)△H3,则△H3=△H2-△H1=-117.31kJ·mol-1,故答案为:-117.31kJ·mol-1;
CH2=CH2(g)+CH3CH3(g)△H3,则△H3=△H2-△H1=-117.31kJ·mol-1,故答案为:-117.31kJ·mol-1;
②. 达到平衡时容器内剩余CH3CH =CH2的物质的量为0.1mol,说明CH3CH =CH2消耗了0.2mol-0.1mol=0.1mol,根据反应方程式可知,CH4也消耗了0.1mol,则5min内该反应的反应速率v(CH4)=0.1mol÷2L÷5min=0.01mol·L-1·min-1,故答案为:0.01mol·L-1·min-1;
③. 达到平衡时CH3CH=CH2(g)、CH4(g)、CH2=CH2(g)、CH3CH3(g)的物质的量分别为0.1mol、0.4mol、0.1mol、0.1mol,计算可得该温度下反应的平衡常数K=0.25,保持温度不变,设向某密闭容器中各充入1mol的CH3CH=CH2和CH4,平衡后二者的物质的量分别为(1-x)mol,根据K=0.25可得:x2÷(1-x)2=0.25,x=1/3,则平衡后CH4的体积分数为33.3%,故答案为:33.3%;
(3). 若原氢氧化钠溶液浓度为3mol·L-1,则100mL该溶液中含有NaOH的物质的量为0.3mol,0.1molCH2=CH2完全燃烧后生成0.2mol CO2,将CO2通入该NaOH溶液中,反应得到Na2CO3和NaHCO3的物质的量之比为1:1的混合溶液,混合溶液呈碱性,CO32-的水解程度大于HCO3-的水解程度,所以CO32-的物质的量比HCO3-的少,应选d点,故答案为:d;
(4). 以氢氧化钠溶液为电解质溶液,CH2=CH2为燃料,CH2=CH2在负极失去电子生成CO32-和H2O,负极反应式为CH2=CH2+16OH--12e-=2CO32-+10H2O,故答案为:CH2=CH2+16OH--12e-=2CO32-+10H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)取1.43g Na2CO3·10H2O溶于水配成100mL溶液,求:Na2CO3物质的量浓度________,取出20mL该溶液用蒸馏水稀释,使Na2CO3溶液物质的量浓度变为0.004mol/L,求加入蒸馏水的体积_________(设稀释时,对溶液体积的影响忽略不计)
(2)用98%的浓H2SO4(ρ=1.84g/cm3)配制500mL0.5mol/L的稀H2SO4,所需浓H2SO4的体积为__________,如果实验室有10mL、20mL、50mL量筒,应选用___________mL量筒,定容时俯视刻度线测定结果会____________________(填偏高、偏低、无影响)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积均为1.0L的两个恒容密闭容器中加入足量的相同质量的固体B,再分别加入0.1molA和0.2molA,在不同温度下反应A(g)+B(s)![]() 2C(g)达到平衡,平衡时A的物质的量浓度c(A)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( )
2C(g)达到平衡,平衡时A的物质的量浓度c(A)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( )
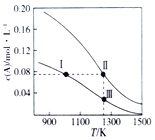
A. 反应A(g)+B(s)![]() 2C(g)△S>0、△H<0
2C(g)△S>0、△H<0
B. A的转化率:a(状态Ⅱ)>a(状态Ⅲ)
C. 体系中c(C)∶c(C,状态Ⅱ)>(C,状态Ⅲ)
D. 化学平衡常数:K(状态Ⅰ)=K(状态Ⅲ)>K(状态Ⅱ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)中国古代四大发明之一——黑火药,它的爆炸反应为:2KNO3 + 3C+S![]() A + N2↑+ 3CO2↑(已配平)
A + N2↑+ 3CO2↑(已配平)
①除S外,上列元素的电负性从大到小依次为_________。
②在生成物中,A的电子式________,含极性共价键的分子的中心原子轨道杂化类型为_____________。
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为________。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为________,Q2+的未成对电子数是__________。
(3)在CrCl3的水溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:[CrCln(H2O)6-n]x++xR-H→Rx[CrCln(H2O)6-n]x++xH+,交换出来的H+经中和滴定,即可求出x和n,确定配离子的组成。将含0.0015 mol [CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1NaOH溶液25.00 ml,可知该配离子的化学式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将a LNH3完全溶于水得到V mL氨水,溶液的密度为ρg·cm-3,溶质的质量分数为ω,溶质的物质的量浓度为c mol/L。下列叙述中正确的是 ( )
A. ω=![]()
B. c=![]()
C. 上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
D. 上述溶液中再加入同体积同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在生产生活中有着重要的应用。请按要求写出相应的方程式。
(1)二氧化硫是一种污染性气体,工业上常利用Fe2+的催化作用,常温下使SO2转化为SO42-,其总反应为2SO2+O2+2H2O=2H2SO4。上述总反应分两步进行,第一步反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,写出第二步反应的离子方程式: _____________________________。
(2)ClO2是一种高效的杀菌消毒剂。氯化钠电解法生产ClO2工艺原理示意图如下:

①氯化钠电解槽内的阳极产物为:__________。
②二氧化氯发生器所产生的气体中二氧化氯的体积分数为:__________。
③ClO2能将电镀废水中的CN-离子氧化成两种无毒气体,自身被还原成Cl-。写出该反应的离子方程式_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】波义耳在《怀疑的化学家》一书中说:“在火的单独作用下,玻璃容器中的水银会丧失其原有的银色,变成一种红色物质;而无须使用任何附加试剂,用这种红色物质也可以得到汞”。该过程可表示为:![]() 。下列说法错误的是
。下列说法错误的是
A. 波义耳所描述的变化属于氧化还原反应 B. 此反应可粗略测定空气中氧气的含量
C. 波义耳所描述的变化是一个可逆的化学反应 D. 用热分解法可由氧化汞制得单质汞
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com