
【题目】下图为几种晶体或晶胞的示意图:
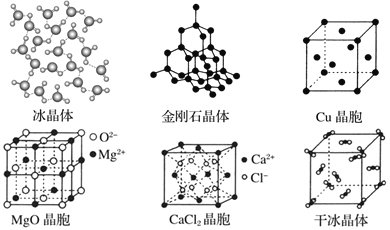
请回答下列问题:
(1)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为_____。
(2)MgO晶体中,距每个O2-最近且距离相等的O2-有_____个。
(3)每个Cu晶胞中实际占有_____个Cu原子;CaCl2晶体中Ca2+的配位数为_____。
(4)冰的熔点远高于干冰,除 H2O 是极性分子、CO2 是非极性分子外, 还有一个重要的原因是____。
(5)金刚石晶胞含有_________个碳原子;若碳原子半径为 r,根据硬球接触模型,列式表示碳原子在晶胞中的空间占有率_____(计算结果为含π的分数,不要化为小数或百分数)。
【答案】金刚石>MgO>CaCl2>冰>干冰 12 4 8 水分子之间形成氢键 8 ![]() π
π
【解析】
(1)熔点的一般规律:原子晶体>离子晶体>分子晶体,同种晶体根据微粒间的作用力大小比较;
(2)MgO的晶体结构与NaCl的晶体结构相似;
(3)Cu原子占据面心和顶点,根据均摊法计算;根据图可知,每个Ca2+周围有8个Cl-,而每个Cl-周围有4个Ca2+;
(4)分子间含有氢键时,其熔沸点较高;
(5)利用均摊法计算。
(1)熔点的一般规律:原子晶体>离子晶体>分子晶体,冰和干冰属于分子晶体,熔点:冰>干冰,MgO和CaCl2属于离子晶体,熔点:MgO>CaCl2,金刚石是原子晶体,则熔点由高到低的顺序为:金刚石、MgO、CaCl2、冰、干冰;
(2)MgO的晶体结构与NaCl的晶体结构相似,以顶点为O2-离子研究,与之最近的O2-离子位于面心,每个顶点为12个面共用,故MgO晶体中一个O2-周围和它最邻近且距离相等的O2-有12个;
(3)Cu原子占据面心和顶点,则每个Cu晶胞中实际占有的原子数为![]() ×8+
×8+![]() ×6=4;根据氯化钙的晶胞图可知,每个Ca2+周围有8个Cl-,而每个Cl-周围有4个Ca2+,所以CaCl2晶体中Ca2+的配位数为8;
×6=4;根据氯化钙的晶胞图可知,每个Ca2+周围有8个Cl-,而每个Cl-周围有4个Ca2+,所以CaCl2晶体中Ca2+的配位数为8;
(4)冰的熔点远高于干冰,除H2O是极性分子、CO2是非极性分子外,水分子间含有氢键,氢键的作用力大于范德华力,所以其熔沸点较高;
(5)晶胞中顶点微粒数为:8×![]() =1,面心微粒数为:6×
=1,面心微粒数为:6×![]() =3,体内微粒数为4,共含有8个碳原子;碳原子的体积为:8×
=3,体内微粒数为4,共含有8个碳原子;碳原子的体积为:8×![]() ×π×r3,设金刚石晶胞的边长为a,晶胞体积为:a3,晶胞内含有四个碳原子,则晶胞体对角线长度与四个碳原子直径相同,即
×π×r3,设金刚石晶胞的边长为a,晶胞体积为:a3,晶胞内含有四个碳原子,则晶胞体对角线长度与四个碳原子直径相同,即![]() a=8r,r=
a=8r,r=![]() a;碳原子的空间利用率为:
a;碳原子的空间利用率为:![]() =
=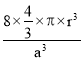 =
=![]() π。
π。


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,CH4和CO2都能与H2O形成笼状结构的水合物晶体,CH4与H2O形成的水合物俗称“可燃冰”。
(1)“可燃冰”晶体中平均每46个H2O分子构建8个笼,其中6个笼分别容纳1个CH4分子,另外2个笼分别容纳1个H2O分子,则“可燃冰”平均组成可表示为________(填化学式)。
(2)已知:
CO2(g)+nH2O(l)=CO2·nH2O(s) △H=-57.98kJ·moI-1
CH4(g)+nH2O(l)=CH4·nH2O(s) △H=-54.49kJ·mol-1
反应CO2(g)+CH4·nH2O(s)=CH4(g)+CO2·nH2O(s)的△H=________kJ·mol-1
(3)科学家提出用CO2“置换”CH4开采海底“可燃冰”的设想,提出该设想的理论依据是________。
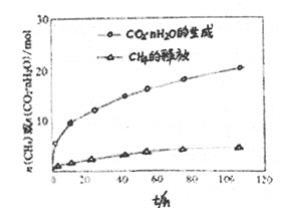
(4)图中显示,CO2·nH2O的生产速率明显大于 CH4·nH2O释放出的速率,其原因是________。
(5)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图。
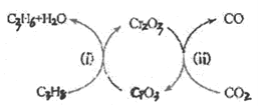
①反应(i)的化学方程式为________。
②该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A.标准状况下,22.4L苯所含有的分子数为NA
B.1mol羟基中含有的电子数为10NA
C.14g C2H4和C3H6混合气体含有的原子数为3NA
D.1L0.1mol/L的醋酸溶液中含有H+个数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为与水相关的部分转化关系(水作反应物或生成物,部分产物和反应条件未列出).下列说法错误的是( )
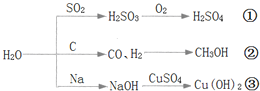
A.图中所示的反应均为氧化还原反应
B.途径![]() 是硫酸型酸雨的形成的重要途径
是硫酸型酸雨的形成的重要途径
C.工业上可用途径![]() 先制取水煤气,再合成甲醇等有机物
先制取水煤气,再合成甲醇等有机物
D.把金属钠投入到硫酸铜溶液中,发生途径![]() 反应,反应不生成铜单质
反应,反应不生成铜单质
查看答案和解析>>
科目:高中化学 来源: 题型:
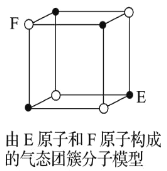
【题目】下列说法中错误的是( )
A.从 CH4、NH4+、SO42- 为正四面体结构,可推测 PH4+、PO43-也为正四面体结构
B.1 mol 金刚石晶体中,平均含有 2 mol C—C 键
C.碱金属单质的熔点从 Li 到 Cs 逐渐减小
D.某气态团簇分子结构如图所示,该气态团簇分子的分子式为 EF 或 FE
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁是海水中含量较多的金属,镁合金及其镁的化合物用途非常广泛。
(1)Mg2Ni是一种储氢合金,已知:
Mg(s)+H2(g)=MgH2(S) △H1=- 74.5kJ·mol-1
Mg2Ni(s)+2H2(g)=Mg2NiH4(s) △H2=- 64.4kJ·mol-l
则:Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s)的△H3=__________.
(2)某科研小组用水氯镁石(主要成分为MgCl2·6H2O)制备金属镁工艺的关键流程如下:

科研小组将MgCl2·6H2O在氩气气氛中进行热重分析,结果如下图(TG表示残留固体质量占原样品总质量的百分数)。
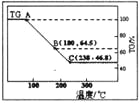
①图中AB线段为“一段脱水”,试确定B点对应固体物质的化学式_________________;图中BC线段为“二段脱水”,在实验中通入H2和Cl2燃烧产物的目的是_______________。
②该工艺中,可以循环使用的物质有_____________。
(3)CH3MgCl是一种重要的有机合成剂,其中镁的化合价是________________,该化合物水解时生成甲烷、氯化镁和氢氧化镁,请写出该反应的化学方程式__________________。
(4)储氢材料Mg(AIH4)2在110~200℃的反应为:Mg(AIH4)2=MgH2+2Al+3H2↑;每转移3 mol电子生成Al的质量为_______________。
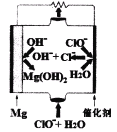
(5)“镁一次氯酸盐”燃料电池的装置如右图所示,该电池的正极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组按如下实验流程探究海带中碘的制取。
实验(一)

实验(二) 另制海带浸取原液,甲、乙两种实验方案如下:

已知:3I2+6NaOH=5NaI+NaIO3+3H2O。
请回答:
(1)步骤X的实验操作名称为_________,所用到的主要仪器有________。
(2)下列有关步骤Y的说法,正确的是_______________。
A.应控制NaOH溶液的浓度和体积 B.将碘转化成离子进入水层
C.主要实验操作为过滤 D.NaOH溶液可以由乙醇代替
(3)步骤Z中加入了H2SO4溶液,请写出发生反应的离子方程式_________________。
(4)实验(二) 中操作W的名称是________________。
(5)方案甲中采用蒸馏不合理,理由是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四种有机化合物的结构简式如下所示,均含有多个官能团,下列有关说法中正确的是( )
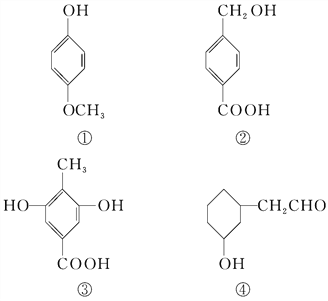
A.①属于酚类,可与NaHCO3溶液反应产生CO2
B.②属于酚类,能使FeCl3溶液显紫色
C.1 mol ③最多能与3 mol Br2发生反应
D.④属于醇类,可以发生消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)汽车尾气中的CO、NO、NO2等有毒气体会危害人体健康,可在汽车尾部加催化转化器,将有毒气体转化为无毒气体。
已知:①2NO(g)+O2(g)=2NO2(g) ΔH1=-112.3 kJ·mol-1
②NO2(g)+CO(g)=NO(g)+CO2(g) ΔH2=-234 kJ·mol-1
③N2(g)+O2(g)=2NO(g) ΔH3=179.5 kJ·mol-1
请写出CO和NO2生成N2、CO2的热化学方程式_________________________。
(2)亚硝酸氯(C1NO)是有机合成中的重要试剂。可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+C12(g) ![]() 2C1NO(g),已知几种化学键的键能数据如下表(NO的结构为N≡O,亚硝酸氯的结构为Cl-N=O):
2C1NO(g),已知几种化学键的键能数据如下表(NO的结构为N≡O,亚硝酸氯的结构为Cl-N=O):
化学键 | N≡O | Cl- Cl | Cl-N | N=O |
键能/kJ·mol-1 | 630 | 243 | a | 607 |
则2NO(g)+C12(g) ![]() 2C1NO(g)反应的ΔH和a的关系为ΔH=________kJ·mol-1。
2C1NO(g)反应的ΔH和a的关系为ΔH=________kJ·mol-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com