
| A. | 具有腐蚀性的药品必须放在玻璃器皿里称量,其他固体药品可直接放在天平托盘上称量 | |
| B. | 使用容量瓶前,在容量瓶中加适量水,用食指摁住瓶塞倒立,如不漏水,即可使用 | |
| C. | 混合浓硫酸和乙醇时,将浓硫酸慢慢加入乙醇试管中并及时搅拌 | |
| D. | 油或酒精着火时都可以用水扑灭 |
分析 A.其他固体药品在称量时不能与托盘直接接触,应垫质量相等的纸片;
B.在容量瓶中加适量水,用食指摁住瓶塞倒立,如不漏水,再将瓶塞旋转180°,用食指摁住瓶塞倒立;
C.浓硫酸倒入其他液体;
D.酒精和水互溶.
解答 解:A.称量固体时,潮湿的或具有腐蚀性的药品,必须放在玻璃器皿里称量,其他固体药品在称量时不能与托盘直接接触,应垫质量相等的纸片,故A错误;
B.容量瓶查漏的方法:在容量瓶中加适量水,用食指摁住瓶塞倒立,如不漏水,再将瓶塞旋转180°,用食指摁住瓶塞倒立,如果不漏水,即可使用,故B错误;
C.稀释浓硫酸时,浓硫酸倒入其他液体,故C正确;
D.酒精和水互溶,可用沙土盖灭,故D错误.
故选C.
点评 本题考查化学实验安全及事故处理,题目难度不大,注意掌握化学实验基本操作方法,明确处理突发事故的方法,确保人身安全、降低国家财产损失.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)已知H-H 键能为436kJ•mol-1,H-N键键能为391kJ•mol-1,根据化学方程式:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1.则N≡N键的键能是945.6kJ•mol-1
(1)已知H-H 键能为436kJ•mol-1,H-N键键能为391kJ•mol-1,根据化学方程式:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1.则N≡N键的键能是945.6kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2O | B. | NO2 | C. | N2O4 | D. | NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铜为电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | 浓硝酸溶液中加入过量铁粉并加热:Fe+3NO3-+6H+$\frac{\underline{\;\;△\;\;}}{\;}$Fe3++3NO2↑+3H2O | |
| C. | 0.01mol/LNH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| D. | 向小苏打溶液中加少量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发酵粉的主要成分为碳酸钠 | |
| B. | 在饱和的碳酸钠溶液中通入二氧化碳,会产生沉淀 | |
| C. | 与盐酸反应的激烈程度:碳酸钠大于碳酸氢钠 | |
| D. | 等质量的碳酸钠和碳酸氢钠与足量的盐酸反应,碳酸钠产生的氢气多 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
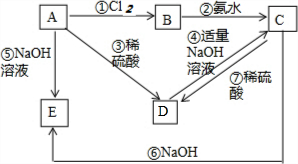 已知金属A为常见的金属单质,根据下列物质的转化关系完成各小题(图中表示主要物质的转化关系,反应中生成的水、气体等物质未标出)
已知金属A为常见的金属单质,根据下列物质的转化关系完成各小题(图中表示主要物质的转化关系,反应中生成的水、气体等物质未标出)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0mol•L-1KNO3溶液:H+、Fe2+、SCN-、SO42- | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-10的溶液:S2-、NO3-、Cl-、Na+ | |
| C. | 0.1 mol•L-1的Na2CO3溶液:K+、Ba2+、NO3-、Cl- | |
| D. | 由水电离出来的c(H+)=10-10mol•L-1的溶液:Na+、SO42-、S2-、HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com