
| A. | 碳酸氢钠可用于制备纯碱、治疗胃酸过多的药剂 | |
| B. | 胃酸过多的人不宜吃海带、鸡肉、苹果等酸性食物 | |
| C. | 人造纤维、合成纤维和光导纤维都是有机高分子化合物 | |
| D. | 1mol葡萄糖能水解成2mol乙醇和2mol二氧化碳 |
分析 A.碳酸氢钠与NaOH、盐酸均反应;
B.苹果为碱性食物;
C.光导纤维的成分为二氧化硅;
D.葡萄糖发生酒化反应生成乙醇和二氧化碳.
解答 解:A.碳酸氢钠与NaOH、盐酸均反应,则碳酸氢钠可用于制备纯碱、治疗胃酸过多的药剂,故A正确;
B.苹果为碱性食物,则胃酸过多的人不宜鸡肉等酸性食物,故B错误;
C.光导纤维的成分为二氧化硅,为无机材料,而人造纤维、合成纤维都是有机高分子化合物,故C错误;
D.葡萄糖发生酒化反应生成乙醇和二氧化碳,而葡萄糖不能水解,故D错误;
故选A.
点评 本题考查物质的性质、应用,为高频考点,把握物质的性质、发生的反应及应用为解答的关键,侧重分析与应用能力的考查,注意化学与生活的联系,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径大小顺序为:M>W>Z>Y>X | |
| B. | X、Y、Z、W四种元索都属于非金属元素,它们之间只能形成共价化合物 | |
| C. | Y、Z、W、M四种元素与X元素分别形成的最简单化合物的沸点依次升高 | |
| D. | X、M均可与W形成可用于自来水杀菌消毒的强氧化性化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发生爆炸的天津滨海仓库存放的电石、氰化钠和硝酸铵等危险化学品均属于电解质 | |
| B. | 在一定条件下,乙酸、氨基乙酸、蛋白质均能与NaOH发生反应 | |
| C. | 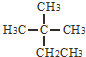 的系统命名为:2-甲基-2-乙基丙烷,其一氯代物有5种 的系统命名为:2-甲基-2-乙基丙烷,其一氯代物有5种 | |
| D. | 1mol化合物(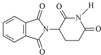 )跟足量NaOH溶液反应最多耗4molNaOH )跟足量NaOH溶液反应最多耗4molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
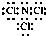 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
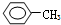
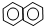
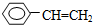
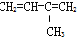
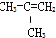
| A. | ④和⑥ | B. | ①、②和③ | C. | ⑤和⑦ | D. | ⑥和⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:A<B<C<D<E | |
| B. | 化合物AE与CE含有相同类型的化学键 | |
| C. | 金属性:D>C | |
| D. | D单质能够溶解于C的最高价氧化物对应的水化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常见单质的沸点:W>Y>Z | |
| B. | W的氢化物为共价化合物 | |
| C. | 原子半径:Y<Z<W | |
| D. | X、Y可以形成既有极性键也有非极性键的化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com