
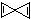 的烃X,根据分析,下列说法中不正确的是( )
的烃X,根据分析,下列说法中不正确的是( )| A. | X的分子式为C5H4 | |
| B. | 分子中氢原子的化学环境只有一种 | |
| C. | 1 mol X在一定条件下可与2 mol氢气发生反应 | |
| D. | X不能使高锰酸钾酸性溶液褪色 |
科目:高中化学 来源: 题型:选择题
| A. | 采用电解水法制取无污染的氢能 | B. | 完善煤液化制取汽油的技术 | ||
| C. | 研制推广以甲醇为燃料的汽车 | D. | 进一步提高石油加工工艺 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
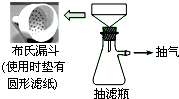 卷心菜中含有丰富的维生素C,维生素C在酸性溶液中能被碘氧化.某实验小组通过如下实验对卷心菜中维生素C的含量进行测定.
卷心菜中含有丰富的维生素C,维生素C在酸性溶液中能被碘氧化.某实验小组通过如下实验对卷心菜中维生素C的含量进行测定.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
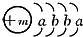 ,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.
,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 42% | B. | 48% | C. | 51% | D. | 65% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化 | |
| B. | NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道 | |
| C. | NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强 | |
| D. | 氨气的相对分子质量大于甲烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com