
| A. | 84g | B. | 65.4g | C. | 67.6g | D. | 53g |
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案科目:高中化学 来源: 题型:选择题
| A. | 1,2-二氯乙烷在NaOH水溶液中加热发生消去反应得到乙炔 | |
| B. | 石油液化气、汽油和石蜡的主要成分都是碳氢化合物 | |
| C. | 除去电石和水反应产生的乙炔中杂质气体,可用稀硫酸洗气 | |
| D. | 由丙烯酸甲酯CH2=CHCOOCH3合成的聚合物为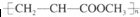 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定浓度的氨水加水稀释的过程中,c(NH4+)/c(NH3•H2O)的比值增大 | |
| B. | 浓度均为0.1 mol•L-1的Na2CO3、NaHCO3混合溶液中:c(CO32-)>c(HCO3-),且2c(Na+)=3c(H2CO3)+3c(HCO3-)+3c(CO32-) | |
| C. | 常温下0.4 mol•L-1 HB溶液和0.2 mol•L-1 NaOH溶液等体积混合后溶液的pH=3,则溶液中微粒浓度存在下面关系:c(Na+)>c(B-)>c(HB)>c(H+)>c(OH-) | |
| D. | 假设HClO的电离平衡常数为Ka,碳酸的电离常数分别记为:Ka1和Ka2,已知:Ka1>Ka>Ka2,则发生反应:2NaClO+CO2(少量)+H2O═Na2CO3+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液加入NaOH并微热,产生能够使湿润的红色石蕊试纸变蓝的无色气体,该溶液中一定含有NH4+ | |
| B. | 向某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成,该溶液中一定含有SO42- | |
| C. | 向某溶液中加入氨水,产生白色沉淀,则该溶液中一定含有Mg2+ | |
| D. | 用铂丝蘸取某溶液在酒精灯火焰上灼烧,若火焰呈黄色,则证明该溶液中无K+离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
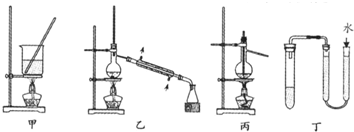
| A. | 用甲装置将海带灼烧成灰 | |
| B. | 分离Na2CO3溶液和CH3COOC2H5,可使用如图乙所示实验装置 | |
| C. | 利用丙装置进行石油分馏 | |
| D. | 利用丁装置检验装置的气密性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2与水反应 | B. | SO2与H2S溶液反应 | ||
| C. | SO2与NaOH溶液反应 | D. | SO2与酸性高锰酸钾溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | H2SO4 | C. | CH3COONa | D. | KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



 .
. .
. 有多种同分异构体,其中含有1个醛基和2个羟基,且核磁共振氢谱显示为6组峰的芳香族化合物共有4种.
有多种同分异构体,其中含有1个醛基和2个羟基,且核磁共振氢谱显示为6组峰的芳香族化合物共有4种. 最合理的方案.
最合理的方案.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com