
 下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.| a | |||||||||||||||||
| b | c | d | e | f | |||||||||||||
| g | h | i | j | k | l | m | |||||||||||
| n | o | ||||||||||||||||
分析 由元素在周期表中位置,可知a为H、b为Li、c为C、d为N、e为O、f为F、g为Na、h为Mg、i为Al、j为Si、k为S、l为Cl、m为Ar、n为K、o为Fe.
(1)o为Fe,原子核外有26个电子,根据能量最低原理书写核外电子排布式;
(2)第三周期中晶体硅为原子晶体,单质的熔点最高;同周期自左而右元素电负性增大,故Cl元素电负性最大,氯气、氩气为气体,氯气相对分子质量更多,分子间作用力更强,故氯气的熔点高于氩气的;
(3)由Si原子跟C原子以1:1相互交替结合而形成的晶体,晶型与晶体硅相同,均属于原子晶体,原子半径越小,形成的共价键键长越短,键能越大,熔沸点越低.
解答 解:由元素在周期表中位置,可知a为H、b为Li、c为C、d为N、e为O、f为F、g为Na、h为Mg、i为Al、j为Si、k为S、l为Cl、m为Ar、n为K、o为Fe.
(1)o为Fe,原子核外有26个电子,根据能量最低原理,核外电子排布式为:1s22s22p63s23p63d64s2,
故答案为:1s22s22p63s23p63d64s2;
(2)第三周期中晶体硅为原子晶体,单质的熔点最高,序号“8”代表Si,同周期自左而右元素电负性增大,故Cl元素电负性最大,氯气、氩气为气体,氯气相对分子质量更多,分子间作用力更强,故氯气的熔点高于氩气的,故电负性最大为2,
故答案为:Si;2;
(3)由Si原子跟C原子以1:1相互交替结合而形成的晶体为SiC,SiC晶型与晶体硅相同,均属于原子晶体,由于C的原子半径小,SiC中C-Si键键长比晶体Si中Si-Si键长短,键能大,因而熔沸点高,
故答案为:SiC;因SiC晶体与晶体Si都是原子晶体,由于C的原子半径小,SiC中C-Si键键长比晶体Si中Si-Si键长短,键能大,因而熔沸点高.
点评 本题考查元素周期表、核外电子排布、电负性、晶体类型与性质等,掌握物质熔沸点高低比较规律,题目培养学生分析能力、知识迁移运用能力.


 能力评价系列答案
能力评价系列答案科目:高中化学 来源: 题型:解答题
| 实验编号 | HA物质的量浓度(mol•L-1) | NaOH物质的量浓度(mol•L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
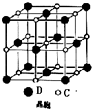 A、B、C、D 是原子序数依次增大的短周期主族元素,A 的基态原子中电 子占据三个能级,且各个能级的电子数相等;B 的一种氧化物为红棕色气体;C 的原子半径 是短周期中最大的.D 的电负性是同周期中最大的;E 是第四周期第VIII族三种元素中原子序数 最小的元素.用元素符号回答下列问题:
A、B、C、D 是原子序数依次增大的短周期主族元素,A 的基态原子中电 子占据三个能级,且各个能级的电子数相等;B 的一种氧化物为红棕色气体;C 的原子半径 是短周期中最大的.D 的电负性是同周期中最大的;E 是第四周期第VIII族三种元素中原子序数 最小的元素.用元素符号回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为SiO2能与强碱溶液反应,所以盛装强碱溶液的试剂瓶不用玻璃塞 | |
| B. | 因为SO2可以使溴水褪色,所以SO2具有漂白性 | |
| C. | 因为某碱性溶液的焰色呈黄色,所以其溶质为NaOH | |
| D. | 因为NH3的水溶液可以导电,所以NH3是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ④⑤⑥ | C. | ②③④ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
| 将氨水滴到氯化铝溶液中至过量 | 将二氧化碳逐渐通入氯水中至过量 | 将铜粉加入到浓硝酸中至过量 | 卤族元素的氧化物沸点随核电荷数的变化 |
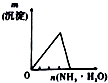 | 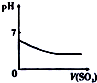 | 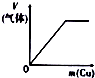 |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com