
【题目】【2017届北京市西城区高三上学期期末考试】25℃时,向10 mL 0.1 mol·L-1 NH4HSO4溶液中逐滴滴入0.1 mol·L-1 NaOH溶液,溶液的pH与NaOH溶液体积关系如右图所示:
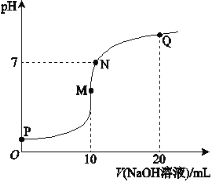
(1)用电离方程式表示P点pH<7的原因是________。
(2)M、Q两点中,水的电离程度较大的是________点。
(3)下列关系中,正确的是________。
a.M点c(Na+)>c(NH4+)
b.N点c(NH4+)+c(Na+)=2c(SO42-)
c.Q点c(NH4+)+c(NH3·H2O)=c(Na+)
【答案】
(1)NH4HSO4=NH4++H++SO42-或HSO4-=H++SO42-
(2)M(3)ab;
【解析】
试题分析:(1)NH4HSO4溶液中存在NH4HSO4 = NH4+ + H+ + SO42-,因此P点pH<7,故答案为:NH4HSO4 = NH4+ + H+ + SO42-;
(2)M点,溶质为硫酸钠和(NH4)2SO4的混合物,(NH4)2SO4水解,促进水的电离,Q点溶质为一水合氨、硫酸钠,一水合氨的电离抑制水的电离,水的电离程度较大的是M点,故答案为:M;
(3)a. M点溶质为硫酸钠和(NH4)2SO4的混合物,铵根离子水解,c(Na+) > c(NH4+),正确;b. N点溶液呈中性,根据电荷守恒,c(NH4+) + c(Na+) = 2c(SO42-),正确;c. Q点溶质为等物质的量一水合氨、硫酸钠,根据物料守恒,2c(NH4+) +2 c(NH3·H2O) = c(Na+),错误;故选ab。


 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】关于粗盐提纯的下列说法正确的是 ( )
A. 溶解粗盐时,应多加水尽量使溶液稀些,防止食盐溶解不完全
B. 滤去不溶性杂质以后,将滤液移至坩埚内加热浓缩
C. 当蒸发到剩有少量液体时,停止加热,利用余热将液体蒸干
D. 将制得的晶体转移到新制过滤器中用大量水进行洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质的晶体中,晶体类型、化学键类型均完全相同的是( )
A.SO2和SiO2
B.CCl4和KCl
C.NaOH和CaCl2
D.CO2和H2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在盛有稀 H2SO4 的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
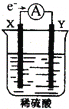
A. 外电路的电流方向为:X→外电路→Y
B. 若两电极分别为Fe和碳棒,则X为碳棒,Y为Fe
C. X极上发生的是还原反应,Y极上发生的是氧化反应
D. 若两电极都是金属,则它们的活动性顺序为X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,反应C(s)+H2O(g)CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
A.增加C的量
B.将容器的体积减小一半
C.保持体积不变,充入氢气使体系的压强增大
D.保持压强不变,充入氮气使体系的体积增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【贵州省贵阳市2017届高三2月适应性考试(一)】硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]俗称莫尔盐,是浅绿色晶体,可溶于水,在100℃~110℃时分解,常用作定量分析中的标准试剂。某化学小组以废铁屑为原料在实验室中进行实验探究——制备硫酸亚铁铵并检验其纯度,过程如下:
I.制备硫酸亚铁铵
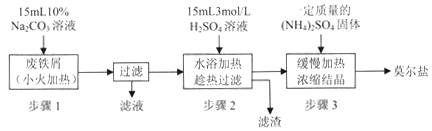
请回答下列问题:
(1)步骤l的作用是_________。(用离子方程式及必要的文字说明);
(2)步骤2中所加硫酸需过量,且不宜等到铁屑完全反应后才过滤,其中蕴含的道理是_______________;
II.测定硫酸亚铁铵的纯度
称取mg实验室制备的硫酸亚铁铵样品,配成500ml溶液,取25. 00mL硫酸亚铁按溶液,用0 . 1mol/L的酸性KMnO4溶液进行滴定,再重复滴定两次。
(3)配制(NH4)2SO4·FeSO4溶液所用的蒸馏水,通常需加热煮沸一段时间后,冷却至室温再使用,这样操作的好处是___________________;
(4)滴定时发生反应的离子方程式为___________________;
(5)滴定终点时的现象为 ___________________;
(6)三次滴定测得酸性KMnO4溶液的用量平均值为VmL,则硫酸亚铁铵样品的纯度为__________;
(7)化学小组分析发现这种检测纯度的方法不够准确,目前处理氮氧化物污染的方法有多种,请你帮助他们设计一种检测方案________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | R |
利用表中元素回答下列问题:
(1)X元素在周期表中的位置为__________。
(2)气态氢化物水溶液呈碱性的元素是_____________,此氢化物的电子式__________。
(3)下列事实能说明Y元素的非金属性比硫元素的非金属性强的是__________。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1mol硫得电子多
c.Y和硫两元素的简单氢化物受热分解,前者的分解温度高
(4)![]() 和
和![]() 是元素R的两种稳定的天然同位素,它们的原子质量分别为a g和b g,在自然界中所占的原子百分比分别为m%和n%,已知12C原子的质量为w g,则
是元素R的两种稳定的天然同位素,它们的原子质量分别为a g和b g,在自然界中所占的原子百分比分别为m%和n%,已知12C原子的质量为w g,则![]() 的相对原子质量的表达式为___________,元素R的相对原子质量的表达式为______________________。
的相对原子质量的表达式为___________,元素R的相对原子质量的表达式为______________________。
(5)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L 2.2mol/L NaOH溶液和1mol O2,则两种气体中相对分子质量较大的气体的分子式及物质的量为__________、_____________,生成硫酸铜的物质的量为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com