
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 9 |
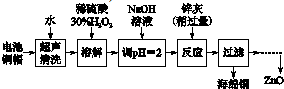
分析 利用废旧电池的铜帽(Cu、Zn总含量约为99%)回收 Cu并制备ZnO,电池铜帽加入水过滤后除去溶于水的杂质,在固体中加入过氧化氢溶解,铜生成硫酸铜溶液,加热煮沸将溶液中过量的H2O2除去,加入氢氧化钠溶液调节溶液PH=2沉淀铁离子,加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物),反应过滤得到海绵铜,沉淀锌离子得到氢氧化锌,分解得到氧化锌;
(1)①酸性条件下Cu与过氧化氢发生氧化还原反应生成硫酸铜和水;
②过氧化氢加热到153℃便猛烈的分解;
(2)①根据淀粉与碘单质作用变蓝解答;
②根据H2O2+2I-+2H+=I2+2H2O解答;
(3)滴加H2O2溶液,使Fe2+转化完全为Fe3+,滴加NaOH溶液,形成氢氧化铁沉淀,除杂后形成氢氧化锌沉淀,过滤、洗涤、干燥900℃煅烧制得氧化锌;
(4)Ksp=c(Zn2+)•c2(OH-)来计算离子浓度.
解答 解:(1)①因为双氧水在酸性溶液中先把铜氧化成氧化铜,当然这是一个微弱的反应,形成一个平衡,但是形成的氧化铜马上就会被稀硫酸溶解,平衡被打破,反应朝正方向进行,故而逐渐溶解,反应的化学方程式为:Cu+H2O2+H2SO4=CuSO4+2H2O;
故答案为:Cu+H2O2+H2SO4=CuSO4+2H2O;
②过氧化氢性质比较稳定,若加热到153℃便猛烈的分解为水和氧气,将溶液中过量的H2O2 除去可加热至沸,
故答案为:加热至沸;
(2)①淀粉溶液为指示剂,当最后一滴Na2S2O3溶液滴入时,溶液蓝色褪去,半分钟颜色不变,说明滴定到达终点,
故答案为:淀粉溶液;蓝色褪去且30秒不恢复蓝色;
②若留有H2O2,加入KI后,会有以下反应:H2O2+2I-+2H+=I2+2H2O误当成2Cu2++4I-=2CuI(白色)↓+I2 生成的碘,使测定结果偏高,
故答案为:偏高;
(3)①向滤液中加入30%H2O2,使其充分反应,目的使Fe2+转化完全为Fe3+,滴加NaOH溶液,调节溶液PH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全,向滤液中滴加1.0mol•L-1NaOH,调节溶液PH约为10(或8.9≤pH≤11),使Zn2+沉淀完全,900℃煅烧,制得氧化锌,由除去铜的滤液制备ZnO的正确实验步骤依次为:⑤④①②③⑥;
故答案为:⑤④①②③⑥;
(4)常温下Ksp[Zn(OH)2]=1.2×10-17,Ksp=c(Zn2+)•c2(OH-),调至pH=9即氢氧根离子浓度为10-5mol/L,使溶液中的Zn2+完全转化为Zn(OH)2沉淀,此时溶液中的c(Zn2+)=$\frac{Ksp}{{c}^{2}(O{H}^{-})}$=$\frac{1.2×1{0}^{-17}}{1{0}^{-10}}$=1.2×10-7mol/L,故答案为:1.2×10-7 mol•L-1.
点评 本题主要考查实验室废弃旧电池的铜帽回收铜和制备ZnO,考查学生对综合实验处理能力,注意实验方案的设计原理和步骤是解答的关键,平时注意打好扎实的基础知识和灵活应用知识解决问题的能力培养,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
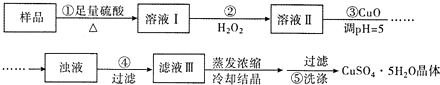
| A. | 步骤②发生的主要反应为:2Fe2++H2O2+2H+=2Fe3++2H2O | |
| B. | 步骤②可用氯水、硝酸等强氧化剂代替H2O2 | |
| C. | 步骤③用 CuCO3代替CuO也可调节溶液的pH | |
| D. | 步骤⑤的操作为:向漏斗中加人少量冷的蒸馏水至浸没晶体,待水自然流下,重复操作 2~3次 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
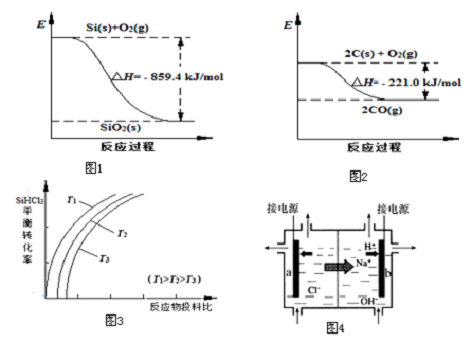
| 物质 | SiHCl3 | SiCl4 | AsCl3 |
| 沸点/℃ | 32.0 | 57.5 | 131.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 草酸钪络盐 | 温度区间(K) | 质量(g) |
| Sc2(C2O4)3•6H2O | 298 | 0.462 |
| 383~423 | 0.372 | |
| 463~508 | 0.354 | |
| 583~873 | 0.138 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0mol•L-1NaClO溶液中:Fe2+、K+、I-、Cl- | |
| B. | 使甲基橙变红色的溶液:Mg2+、K+、SO42-、NO3- | |
| C. | 0.1 mol•L-1NaAlO2 溶液:H+、Na+、Cl-、SO42- | |
| D. | 由水电离出的c(OH-)=1×10-12mol•L-1的溶液中:NH4+、HCO3-、Na+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
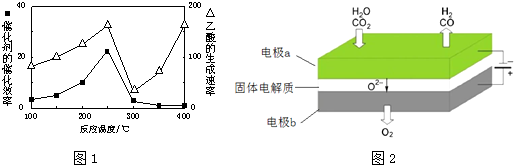
 采用MnO2.其工作原理如图丙所示.电池放电时Na+由a(填写“a”或“b”,下同)极区移向b极区,该电池的负极反应式为BH4-+8OH--8e-=BO2-+6H2O.
采用MnO2.其工作原理如图丙所示.电池放电时Na+由a(填写“a”或“b”,下同)极区移向b极区,该电池的负极反应式为BH4-+8OH--8e-=BO2-+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2(SO4)3可除去酸性废水中的悬浮颗粒 | |
| B. | 医药中常用酒精来消毒,是因为酒精能够使细菌蛋白发生变性 | |
| C. | 煤通过气化、液化和干馏等可获得清洁能源和重要的化工原料 | |
| D. | 高锰酸钾溶液和双氧水进行环境消毒时原理相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com