
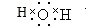 .
.分析 (I)无机盐A是由两种元素组成,将其溶于水,通入适量黄绿色气体B,则B为氯气,然后向反应后的溶液中加入四氯化碳并振荡、静置,溶液分层,下层液体呈橙红色,则A中含有溴元素,分液后取上层溶液,经元素分析,溶质为漂白粉的主要成分之一,则溶液中有钙元素,所以A为溴化钙,往此溶液通入CO2和NH3可获得纳米材料E和铵态氮肥F,则F为NH4Cl,E为CaCO3;
(1)工业上用氯气与氢氧化钙反应制取漂白粉;
(2)CO2和NH3两气体中,由于氨气极易溶于水,而二氧碳在水中溶解度不大,所以应该先通入溶液中的是 NH3;CO2、NH3、Ca2+和H2O反应生成CaCO3和NH4+.
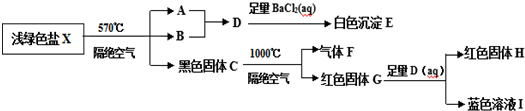
(II)浅绿色盐X在570℃、隔绝空气条件下受热分解为非氧化还原反应,得到A、B和黑色固体C,常温下B呈液态且1个B分子含有10个电子,B为水,A和水反应生成的D能和氯化钡反应生成白色沉淀E,E只能为硫酸钡,23.3g白色沉淀E的物质的量为0.1mol,黑色固体C可能为四氧化三铁、氧化铜、碳等,黑色固体C隔绝空气在1000℃反应生成气体F和红色固体G,G能和硫酸反应生成红色固体和蓝色溶液应为氧化亚铜在酸性溶液中的歧化反应,所以黑色固体G为氧化亚铜,气体F为氧气,红色H为铜,蓝色溶液I为硫酸铜.
(1)水是共价化合物,原子间通过共用电子对形成化学键;
(2)红色固体G为氧化亚铜,溶于稀硝酸,+1价铜被氧化,硝酸被还原;
(3)依据以上分析得n(CuO):n(SO3)=1:4,结合质量守恒分析解答;
(4)黑色固体C为氧化铜,与氨气反应生成氮气(气体丙是大气主要成分之一)、铜或氧化亚铜和水.
解答 解:(Ⅰ)无机盐A是由两种元素组成,将其溶于水,通入适量黄绿色气体B,则B为氯气,然后向反应后的溶液中加入四氯化碳并振荡、静置,溶液分层,下层液体呈橙红色,则A中含有溴元素,分液后取上层溶液,经元素分析,溶质为漂白粉的主要成分之一,则溶液中有钙元素,所以A为溴化钙,往此溶液通入CO2和NH3可获得纳米材料E和铵态氮肥F,则F为NH4Cl,E为CaCO3,
(1)工业上制取漂白粉的化学反应方程式2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(2)CO2和NH3两气体中,由于氨气极易溶于水,而二氧碳在水中溶解度不大,所以应该先通入溶液中的是 NH3,这样便于两气体和溶液充分反应,制备E和F的离子反应方程式为Ca2++CO2+2NH3+H2O=CaCO3↓+2NH4+,
故答案为:NH3;Ca2++CO2+2NH3+H2O=CaCO3↓+2NH4+.
(II)浅绿色盐X在570℃、隔绝空气条件下受热分解为非氧化还原反应,得到A、B和黑色固体C,常温下B呈液态且1个B分子含有10个电子,B为水,A和水反应生成的D能和氯化钡反应生成白色沉淀E,E只能为硫酸钡,23.3g白色沉淀E的物质的量为n=$\frac{23.3g}{233g/mol}$=0.1mol,黑色固体C可能为四氧化三铁、氧化铜、碳等,黑色固体C隔绝空气在1000℃反应生成气体F和红色固体G,G能和硫酸反应生成红色固体和蓝色溶液应为氧化亚铜在酸性溶液中的歧化反应Cu2O+H2SO4=CuSO4+Cu+H2O,所以黑色固体G为氧化亚铜,气体F为氧气,红色H为铜,蓝色溶液I为硫酸铜,逆推可得:一定量的浅绿色盐X中n(S)=0.1mol,28.8g红色固体G为氧化亚铜,n(Cu2O)=$\frac{28.8g}{144g/mol}$=0.2mol,12.8g红色固体H,n(Cu)=0.2mol,浅绿色盐X中n(Cu)=0.4mol,n(CuO)=0.4mol,浅绿色盐X在570℃、隔绝空气条件下受热分解为非氧化还原反应,n(S)=0.1mol,n(CuO):n(SO3)=1:4,
浅绿色盐X,仅含四种元素,不含结晶水,设化学式为:Cu4(OH)mSO4,Cu4(OH)mSO4$\frac{\underline{\;\;△\;\;}}{\;}$4CuO+SO3↑+(m-1)H2O↑,根据氧元素守恒得:m=4,符合M(X)<908g•mol-1,则该反应流程为:X在隔绝空气、570℃温度下加热Cu4(OH)6SO4$\frac{\underline{\;\;△\;\;}}{\;}$4CuO+SO3↑+3H2O↑,A和B反应SO3+H2O=H2SO4,硫酸与足量氯化钡反应:H2SO4+BaCl2=BaSO4↓+2HCl,白色沉淀E为BaSO4,黑色固体C为氧化铜,在1000℃反应生成气体F为氧气,红色固体G为氧化亚铜4CuO$\frac{\underline{\;1000℃\;}}{\;}$2Cu2O+O2↑,G氧化亚铜和硫酸发生歧化反应:Cu2O+H2SO4=CuSO4+Cu+H2O,红色H为铜,蓝色溶液I为硫酸铜.
(1)水是共价化合物,氢原子和氧原子之间以共价键结合,其电子式为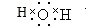 ,
,
故答案为: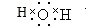 ;
;
(2)红色固体G为氧化亚铜,Cu2O中+1价的铜被硝酸氧化,稀硝酸被还原成一氧化氮,反应为:3Cu2O+14H++2NO3-═6Cu2++2NO↑+7H2O,
故答案为:3Cu2O+14H++2NO3-═6Cu2++2NO↑+7H2O;
(3)浅绿色盐X中n(Cu)=0.4mol,n(S)=0.1mol,n(CuO):n(SO3)=1:4,仅含四种元素,不含结晶水,设化学式为:Cu4(OH)mSO4,Cu4(OH)mSO4$\frac{\underline{\;\;△\;\;}}{\;}$4CuO+SO3↑+(m-1)H2O↑,根据氧元素守恒得:m=4,则该反应流程为:X在隔绝空气、570℃温度下加热Cu4(OH)6SO4$\frac{\underline{\;\;△\;\;}}{\;}$4CuO+SO3↑+3H2O,
故答案为:Cu4(OH)6SO4;Cu4(OH)6SO4$\frac{\underline{\;\;△\;\;}}{\;}$4CuO+SO3↑+3H2O;
(4)空气主要成分为氧气、氮气,黑色固体C为氧化铜,与氨气反应生成氮气、铜(0价)或氧化亚铜(铜为+1价)和水,反应为:3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O,
故答案为:3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O.
点评 本题考查了物质组成的推断,涉及离子的检验、物质的性质等知识点,熟悉元素化合物的性质、知道流程图中每一步发生的反应及反应现象是解本题关键,题目较大.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:解答题

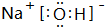 ,其晶体类型为离子晶体.
,其晶体类型为离子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将溶液稀释到原体积的10倍 | B. | 加入适量的醋酸钠固体 | ||
| C. | 加入等体积0.2mol/L盐酸 | D. | 提高溶液的温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷分子的比例模型是: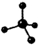 | B. | 二氧化碳的电子式: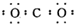 | ||
| C. | CO2的比例模型: | D. | HClO的结构式为:H-O-Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将FeCl3溶液直接蒸干制取无水FeCl3固体 | |
| B. | 配制CuSO4溶液时,需加入少量的稀硫酸以抑制Cu2+水解 | |
| C. | 酸碱中和滴定实验中,用待测溶液润洗锥形瓶以减小实验误差 | |
| D. | 用广泛pH试纸测定溶液pH时,试纸需预先用蒸馏水湿润 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
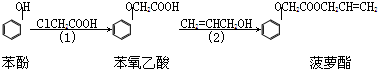
 (注明反应条件).
(注明反应条件).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内生成n mol O2的同时生成n mol NO2 | |
| B. | 单位时间内生成n mol O2的同时生成2n mol NO | |
| C. | 混合气体的密度不再改变的状态 | |
| D. | 混合气体的颜色不再改变的状态 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com