
| A. | I | B. | F | C. | H | D. | Mn |
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙分解 | B. | 甲烷在氧气中燃烧 | ||
| C. | 灼热的炭与二氧化碳反应 | D. | Ba(OH)2•8H2O与NH4Cl反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2g D216O中含有的质子数、中子数和电子数均为NA | |
| B. | 标准状况下,22.4L SO3含有的共价键数目为3NA | |
| C. | 80g CuO和Cu2S的混合物中,所含铜原子数为NA | |
| D. | 常温常压下,16g O2作氧化剂时转移电子数不一定为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向含碘化钾、淀粉的溶液中滴加FeCl3溶液,溶液变蓝 | |
| B. | 向FeBr2溶液中通入少量Cl2,发生反应的离子方程式为:2Br-+Cl2=Br2+2Cl- | |
| C. | 某溶液中含有Fe2+、Cl-、I-,为了除去I-而不减少其他离子,可通入过量氯气 | |
| D. | 向含有NaBr、NaI的溶液中通入适量氯气,充分作用后,将溶液蒸干、灼烧,可能得到NaCl和NaI的固体混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
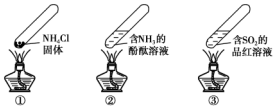 “封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是( )
“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是( )| A. | 加热时,①中上部汇集了NH4Cl固体 | |
| B. | 加热时,②中溶液变红,冷却后又都变为无色 | |
| C. | 加热时,③中溶液变红,冷却后红色褪去,体现SO2的漂白性 | |
| D. | 三个“封管实验”中所发生的化学反应都是可逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
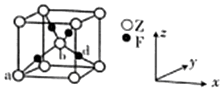 已知原子序数依次增大的X、Y、Z、D、E、F六种前四周期元素.X是宇宙中最丰富的元素;Y和Z基态原子的未成对电子数均等于周期序数;D的氧化物是典型的两性氧化物;E是所在周期中电负性最大的元素;F的单质是一种紫红色金属,在潮湿空气中该金属表面会慢慢生成一种绿色固体.请回答下列问题(用元素符号或化学式表示):
已知原子序数依次增大的X、Y、Z、D、E、F六种前四周期元素.X是宇宙中最丰富的元素;Y和Z基态原子的未成对电子数均等于周期序数;D的氧化物是典型的两性氧化物;E是所在周期中电负性最大的元素;F的单质是一种紫红色金属,在潮湿空气中该金属表面会慢慢生成一种绿色固体.请回答下列问题(用元素符号或化学式表示):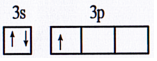 ,其第一电离能反常地低于同周期前一种元素,原因是Mg原子的3s2全充满,反而比Al原子3p1稳定.
,其第一电离能反常地低于同周期前一种元素,原因是Mg原子的3s2全充满,反而比Al原子3p1稳定. ,该分子的空间构型是直线型.
,该分子的空间构型是直线型.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
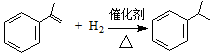 下列说法中正确的是( )
下列说法中正确的是( )| A. | 异丙烯苯与苯互为同系物 | |
| B. | 异丙烯苯不能发生取代反应 | |
| C. | 异丙苯的一溴代物有5种 | |
| D. | 0.5mol 异丙苯完全燃烧消耗氧气5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 浓度 时间(秒) 反应条件 | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| (Ⅰ)无催化剂、不加热 | 几乎 不反应 | 几乎 不反应 | 几乎 不反应 | 几乎 不反应 |
| (Ⅱ)无催化剂、加热 | 360 | 480 | 540 | 720 |
| (Ⅲ)MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
| 催化剂 (MnO2) | 操作情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5分钟 |
| 块状 | 反应较慢,火星红亮但木条未复燃 | 30分钟 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com