
| A、①② | B、②③⑤ | C、①④ | D、②④ |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、电解熔融氯化钠制金属钠 |
| B、石灰石是炼铁的原料之一 |
| C、氯气通入澄清石灰水中制漂白粉 |
| D、硫酸工业的主要设备有沸腾炉、接触室、吸收塔 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入水中,浮在水面上的为植物油 |
| B、尝一尝,能食用的为植物油 |
| C、点燃,能燃烧的为矿物油 |
| D、加入足量氢氧化钠溶液共煮,不再分层的为植物油 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、常温下
| ||
| B、加Zn能放出H2的溶液:Mg2+、SO42-、Cl-、HCO3- | ||
| C、含有较多Fe3+的溶液:Na+、H+、Cl-、SO42- | ||
| D、滴入KSCN溶液呈红色的溶液:K+、Na+、SO42-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向血红色的Fe(SCN)3溶液中加入少量KSCN固体,溶液颜色加深 |
| B、合成氨工业中选择较大压强和较高温度以提高NH3的产率 |
| C、向水中加入酸或碱均会抑制水的电离 |
| D、浓氯化铵溶液可以溶解Mg(OH)2浊夜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、[Ag(NH3)2]+、K+、OH-、 |
| B、Fe3+、Cl-、I- |
| C、H+、Al3+、F- |
| D、ClO-、Na+、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
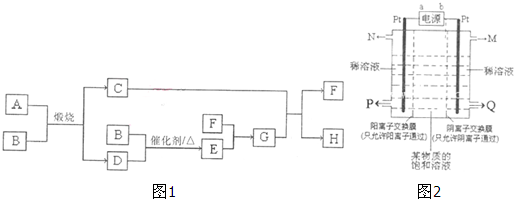
查看答案和解析>>
科目:高中化学 来源: 题型:
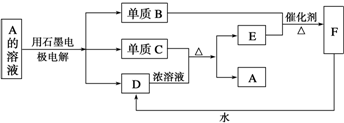
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向水中通入氯气:Cl2+H2O═2H++Cl-+ClO- |
| B、向氯化铁溶液中加入铜:2Fe3++3Cu═2Fe+3Cu2+ |
| C、将含等物质的量的NaHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O |
| D、镁和稀硝酸反应:Mg+2H+═Mg2++H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com