
| A. | 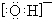 | B. | 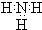 | C. | 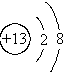 | D. | 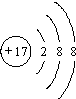 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. ,A2C的结构式:H-O-H.
,A2C的结构式:H-O-H. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 24g/mol | B. | 74g/mol | C. | 148g/mol | D. | 40g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应的平衡常数越大,反应进行的速率越快 | |
| B. | 加热、蒸干NaAlO2溶液和AlCl3溶液,并灼烧都得到Al2O3 | |
| C. | CH3COOH 溶液加水稀释后,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$的值不变 | |
| D. | 0.1mol•L-1CH3COONa溶液中加入少量固体NaOH,碱性增强,平衡向水解方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | 原子半径最小 |
| B | 核外3个能级上的电子数相等 |
| C | 其氢化物的沸点比同族相邻周期元素氢化物的沸点高 |
| D | 2p轨道上成对电子数与未成对电子数相等 |
| E | N层电子数为1,内层轨道全部排满电子 |
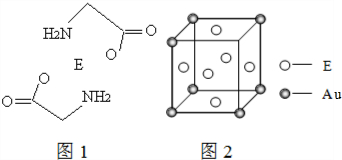
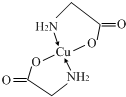 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阴离子数和阳离子数 | |
| B. | 阳离子的正电荷总数和阴离子的负电荷总数 | |
| C. | 阴、阳离子的质量 | |
| D. | 每个阳离子与每个阴离子所带的电荷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com