
【题目】下列有关氧化还原反应的叙述中,正确的是( )
A.一定有氧元素参加
B.氧化反应一定先于还原反应发生
C.氧化剂本身发生氧化反应
D.一定有电子转移(得失或偏移)
科目:高中化学 来源: 题型:
【题目】元素是构成我们生活的世界中一切物质的“原材料”。
Ⅰ.1869年,门捷列夫在前人研究的基础上制出了第一张元素周期表,如图所示。
Ni=Co=59 | |||||
H=1 | Cu=63.4 | Ag=108 | Hg=200 | ||
Be=9.4 | Mg=24 | Zn=65.2 | Cd=112 | ||
B=11 | Al=27.4 | ?=68 | Ur=116 | Au=198? | |
C=12 | Si=28 | ?=70 | Sn=118 | ||
N=14 | P=31 | As=75 | Sb=122 | Bi=210? | |
O=16 | S=32 | Se=79.4 | Te=128? | ||
F=19 | Cl=35.5 | Br=80 | I=127 | ||
Li=7 | Na=23 | K=39 | Rb=85.4 | Cs=133 | Tl=204 |
Ca=40 | Pb=207 |
(1)门捷列夫将已有元素按照相对原子质量排序,同一_____(填“横行”或“纵列”)元素性质相似。
(2)结合表中信息,猜想第5列方框中“Te=128?”的问号表达的含义是___________。
Ⅱ.X、Y、Z、W是现在元素周期表中的短周期元素,它们的相对位置如下图所示,其中 Y 元素原子核外最外层电子数是其电子层数的3倍。
X | Y | |
Z | W |
请回答下列问题:
(1)W位于周期表中的位置____________________。
(2)比较Y、Z气态氢化物的稳定性______________(用分子式表示)。
(3)科学家们认为存在含氢量最高的化合物XH5,预测其与水剧烈反应放出气体,所得水溶液呈弱碱性,写出该反应的化学方程式___________,XH5是离子化合物,它的电子式为________。
(4)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列物质分别注入水中,振荡后静置,能分层浮于水面的是( )
①苯 ②乙酸乙酯 ③乙醇 ④乙酸 ⑤油脂 ⑥四氯化碳
A. ①②③ B. ①③⑤ C. ①②⑤ D. ①②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
砷主要以硫化物矿的形式(如雄黄,雌黄等)存在于自然界。砷及其化合物主要用于合金冶炼、农药医药、颜料等工业。请根据有关砷及其化合物的转化关系和晶体结构图,回答下列问题:

(1)量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道,电子除空间运动状态外,还有一种运动状态叫做__________________。
(2)基态砷原子的核外电子排布式为_______________,与砷同周期的p区元素中第一电离能大于砷的元素有_______________ (填元素符号)。
(3)雄黄分子中,As原子的杂化方式为_________________。
(4)雄黄可经过如下三步反应生成雌黄:

①反应Ⅲ的化学方程式为________________________。
②SO2的中心原子的VSEPR构型为______________________。
③亚砷酸属于三元弱酸,酸性:H3AsO3________HNO2(填“>”或“<”),请根据物质结构的知识解释原因:____________________________。
(5)①图3是由Li、Fe和As三种元素组成的超导体化合物的晶体结构(该晶胞是立方晶胞,Li在晶胞内部),该晶体的化学式为_____________________。
②若1号原子的坐标为(0,0,0),2号原子的坐标为(1/4,1/4,1/3),则3号原子的坐标为___________。
③已知该晶胞参数ɑ=0.53nm,阿伏加德罗常数的值为NA,则该晶体的密度为_______g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物中,实验式相同,且既不是同系物,又不是同分异构体的是( )
A. 1-辛烯和3-甲基-1-丁烯 B. 苯和乙炔
C. 1-氯丙烷和2-氯丙烷 D. 甲苯和乙苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,用0.0200mol/L稀盐酸滴定20.00mL0.0200mol/LNaY溶液,溶液中水的电离程度随所加稀盐酸的体积变化如图所示(忽略滴定过程中溶液的体积变化),则下列有关说法正确的是
已知:K(HY)=5.0×10-11

A. 可选取酚酞作为滴定指示剂 B. M点溶液的pH>7
C. 图中Q点水的电离程度最小,Kw<10-14 D. M点,c(Na+)=c(HY)+c(Y-)+c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如图所示.下列说法中正确的是( )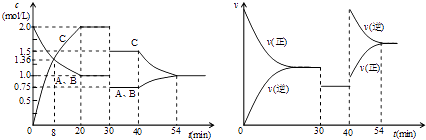
A.30min时降低温度,40min时充入生成物C
B.0~8min内A的平均反应速率为0.08mol/(Lmin)
C.反应方程式中的x=1,正反应为吸热反应
D.20min~40min间该反应的平衡常数均为8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期。B元素含有3个能级,且毎个能级所含的电子数相间;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子。请回答下列问题:
(1)请写出:D基态原子的价层电子排布图__________;F基态原子的外围电子排布式:_________。
(2)下列说法错误的是_________。
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2>CO2
B.电负性顺序:B<C<D
C.N2与CO为等电子体,结构相似。
D.稳定性:H2O>H2S,水分子更稳定的原因是水分子间存在氢键
(3)F离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。向F硫酸盐溶液中通入过量的C与A形成的气体X可生成[F (X)4]2+,该离子的结构式为______(用元素符号表示)。
(4)某化合物与F(I)(I表示化合价为+1)结合形成图1所示的离子,该离子中碳原子的杂化方式有________。
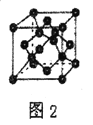
(5)B单质的一种同素异形体的晶胞如图2所示,则一个晶胞中所含B原子数为_______。
(6)D与F形成离子个数比为1:1的化合物,晶胞与NaCl类似,设D离子的半径为a pm, F离子的半径b pm,求该晶胞的空间利用率________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com