
 某学习小组为证明并观察铜与稀HNO3反应的产物是NO,设计了如图1所示的实验装置.请你根据他们的思路,回答有关的问题.
某学习小组为证明并观察铜与稀HNO3反应的产物是NO,设计了如图1所示的实验装置.请你根据他们的思路,回答有关的问题.分析 ①铜与稀硝酸反应生成硝酸铜、NO和水;
②对于气体的制备,组装完装置,需检查气密性;
③一氧化氮易与空气中氧气反应,故制取一氧化氮之前,应先排净装置中空气,可用碳酸钙和硝酸反应产生的二氧化碳来排净空气;
④氮的氧化物为大气污染物,应用碱液来吸收;
⑤一氧化氮和氧气反应生成二氧化氮;
⑥从节约原理和防止污染环境分析;
⑦增加如图2所示装置,在步骤②完成后,当有明显现象时,说明装置是充满二氧化碳,这样可以排除空气中的氧气对实验的干扰.
解答 解:①铜与稀硝酸反应生成硝酸铜、NO和水,反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
②对于气体的制备,组装完装置,需检查气密性,
故答案为:气密性;
③一氧化氮易与空气中氧气反应,故制取一氧化氮之前,应先排净装置中空气,可用碳酸钙和硝酸反应产生的二氧化碳来排净空气;
故答案为:CaCO3颗粒;
④一氧化氮易和空气中氧气反应,故应先排净装置中空气,所以实验②的目的是利用CO2排出试管中的空气,防止O2与NO反应,反应的离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O,
故答案为:CaCO3+2H+=Ca2++CO2↑+H2O;利用CO2排出试管中的空气,防止O2与NO反应;
⑤一氧化氮为无色气体,二氧化氮为红棕色气体,当通入空气,氧气和一氧化氮反应生成二氧化氮,反应方程式为2NO+O2=2NO2,所以实验步骤⑤的目的是气体由无色变红棕色证明Cu与稀硝酸反应生成NO,
故答案为:2NO+O2=2NO2;气体由无色变红棕色证明Cu与稀硝酸反应生成NO;
⑥使用可抽动的铜丝能随时控制反应的开始和结束,节约药品用量,减少污染气体的产生,使用蘸有NaOH溶液的棉花团封住导管口,可防止NO和NO2气体逸出污染大气;
故答案为:使用可抽动的铜丝能随时控制反应的开始和结束,节约药品用量,减少污染气体的产生(或使用蘸有NaOH溶液的棉花团封住导管口,可防止NO和NO2气体逸出污染大气);
⑦增加如图2所示装置,在步骤②完成后,当有明显现象时,说明装置是充满二氧化碳,这样可以排除空气中的氧气对实验的干扰,所以该同学的做法通过石灰水变浑浊的现象准确判断试管内无空气后,才进行步骤④,使得出的结论更科学,
故答案为:通过石灰水变浑浊的现象准确判断试管内无空气后,才进行步骤④,使得出的结论更科学.
点评 本题以硝酸的性质为载体综合考查性质实验的设计,为高考常见题型,侧重于学生的分析能力和实验能力的考查,注意把握相关物质的性质,明确实验目的和原理是解答该题的关键,注意相关实验操作方法的注意事项,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 0.168升 | B. | 0.14升 | C. | 0.336升 | D. | 0.24升 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
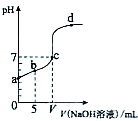 向10.00ml 0.01mol/L某一元酸HA溶液中逐滴加入0.01mol/L NaOH溶液,溶液pH变化曲线如图所示.下列说法不正确的是( )
向10.00ml 0.01mol/L某一元酸HA溶液中逐滴加入0.01mol/L NaOH溶液,溶液pH变化曲线如图所示.下列说法不正确的是( )| A. | HA是弱酸 | |
| B. | b点表示的溶液中:2c(Na+)═c(A-)+c(HA) | |
| C. | b、c、d点表示的溶液中:c(Na+)+c(H+)═c(A-)+c(OH-) | |
| D. | c点时:V=10.00 ml |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2Fe(SO4)2]<c[(NH4)2SO4]<c(NH4Cl) | |
| B. | 已知25°C时Ksp(AgCl)=1.8×10-10,则在0.1mol•L-1AgCl3溶液中,Ag+的物质的量浓度最大可达到6.0×10-10mol•L-1 | |
| C. | 0.2mol•L-1 HCl溶液与等体积0.05 mol•L-1 Ba(OH)2溶液混合后,溶液的pH=1 | |
| D. | 室温下,0.1mol•L-1NaHA溶液的pH=4,则有C(HA-)>C(H+)>C(A2-)>C(H2A) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醛 | B. | 维生素E | C. | 小苏打 | D. | 苯甲酸及其钠盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度不变,缩小体积,CIF的转化率增大 | |
| B. | 温度不变,增大体积,CIF3的产率提高 | |
| C. | 升高温度,增大体积,有利于平衡向正反应方向移动 | |
| D. | 降低温度,体积不变,F2的转化率降低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com