
| A. | 要除去氯化镁酸性溶液里少量的氯化铁,可以选用氢氧化钠 | |
| B. | 镀锡铁表面有划痕是,仍然能阻止铁被氧化 | |
| C. | 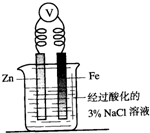 向图烧杯内的溶液中加入黄色的K3[Fe(CN)6]溶液,一段时间后可看到Fe电极附近有蓝色沉淀生成 | |
| D. | 各种原生铜的硫化物经氧化、淋滤作用变成硫酸铜,遇到深层的ZnS和PbS,便慢慢地使之转变为CuS |
分析 A.加入NaOH易生成氢氧化镁沉淀;
B.Fe比Sn活泼,Fe作原电池的负极被腐蚀;
C.锌为负极,铁为正极;
D.硫化铜沉淀溶解度小于硫化铅.
解答 解:A.加入NaOH易生成氢氧化镁沉淀,且混入NaCl杂质,故A错误;
B.镀锡铁破损后发生电化学腐蚀,因Fe比Sn活泼,Fe作原电池的负极被腐蚀,故B错误;
C.形成原电池,Zn作负极,所以在Fe电极附近加入K3[Fe(CN)6]不会有蓝色沉淀生成,故C错误;
D.硫化铜沉淀溶解度小于硫化铅,实现沉淀的转化,故D正确.
故选D.
点评 本题主要考查较为综合,涉及元素化合物以及原电池知识,为高频考点,侧重于学生的分析能力和实验原理的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | ① | ||||||
| 2 | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
 ,该位于周期表三周期IVA族;元素名称为硅,其最高价氧化物的化学式为SiO2.
,该位于周期表三周期IVA族;元素名称为硅,其最高价氧化物的化学式为SiO2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol H2O的质量为18g/mol | B. | CH4的摩尔质量为16g | ||
| C. | 3.01×1023个SO2分子的质量为32g | D. | 标准状况下,1molH2O体积是22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 见光易分解的AgBr常用做感光材料 | B. | 浓硝酸可刻蚀石英制艺术品 | ||
| C. | 84消毒液的有效成分是NaClO | D. | 浓氨水可检验氯气管道泄漏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5g | B. | 3g | C. | 5g | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,28 g N2含有的分子数为2NA | |
| B. | 25℃、101.3kPa时,11.2L H2中含有的原子数为NA | |
| C. | 标准状况下,1mol CCl4的体积约为22.4 L | |
| D. | 2.3g的金属钠变为钠离子时失去的电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
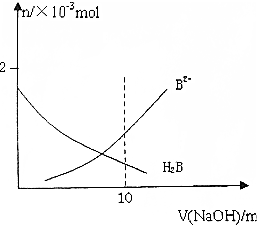 常温下,向10mL 0.2mol/L H2B溶液中滴加0.2mol/L NaOH溶液.溶液中H2B和B2-的物质的量变化如图,根据图示判断,下列说法正确的是( )
常温下,向10mL 0.2mol/L H2B溶液中滴加0.2mol/L NaOH溶液.溶液中H2B和B2-的物质的量变化如图,根据图示判断,下列说法正确的是( )| A. | 当V(NaOH)=10mL时,溶液中有关粒子浓度大小关系为:c(Na+)>c(B2-)>c(HB-)>c(H2B)>c(OH-) | |
| B. | 等体积等浓度的NaOH溶液与H2B溶液混合后其溶液中,水的电离程度被促进 | |
| C. | 向NaHB溶液中加水稀释,溶液中c(Na+),c(B2-),c(HB-),c(OH-)均减小 | |
| D. | 当V(NaOH)=10mL时,溶液中存在下列关系c(H2B)+c(H+)=c(OH-)+c(B2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有盐酸的洁厕剂和含有次氯酸钠的消毒液混用可以增强洗涤和消毒的效果 | |
| B. | 过量的Fe和Cu在等物质的量的Cl2中燃烧,转移的电子数相等 | |
| C. | 等体积、等浓度的NH4Cl溶液和稀氨水中,所含NH4+的数目相等 | |
| D. | 等物质的量的过氧化钡(BaO2)和Ba(OH)2固体中,阴阳离子个数比均为2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com