
| A、氧化剂和还原剂的物质的量之比为1:8 |
| B、该过程说明Fe(NO3)2不宜加酸酸化 |
| C、若有1mol NO3-发生氧化反应,则转移8mol e- |
| D、该过程说明氧化性:NO3->Fe3+ |


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案科目:高中化学 来源: 题型:
| A、C4H10、C3H6、 |
| B、C4H8、C3H8 |
| C、C4H10、C2H4 |
| D、C2H6、C3H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3COONa溶液中加入少量KNO3后溶液一定有:c(Na+)+c(H+)=(CH3COO-)+c(OH-) |
| B、向氨水中滴加稀硫酸至溶液呈中性:c(NH4+)=c(SO42-)>c(OH-)=c(H+) |
| C、向l00mL 3mol/L的NaOH溶液中通入标准状况下体积为4.48L的CO2:3c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)] |
| D、等物质的量浓度的①NH4HSO4、②NH4HCO3、③NH4Cl溶液中,c(NH4+)的大小关系:①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| CO2 | H2 | CO | H2O | |
| 甲 | a mol | a mol | 0 mol | 0 mol |
| 乙 | 2a mol | a mol | 0 mol | 0 mol |
| 丙 | 0 mol | 0 mol | 2a mol | 2a mol |
| 丁 | a mol | 0 mol | a mol | a mol |
| A、丙>乙=丁>甲 |
| B、乙>丁>甲>丙 |
| C、乙=丁>丙=甲 |
| D、丁>丙>乙>甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Ba2+、Cl-、SO42- |
| B、K+、Na+、NO3-、OH- |
| C、OH-、NH4+、Fe3+、SO42- |
| D、H+、Cl-、CH3COO-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③④⑤ | B、①②④ |
| C、①③⑤ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、采用“绿色化学”工艺,使原料尽可能转化为所需要的物质 |
| B、大量开采地下水,以满足社会对水的需求 |
| C、减少使用对大气臭氧层起破坏作用的氟氯代烷 |
| D、节约能源,提高能源利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配制0.10 mol/L CH3COOH溶液,测溶液的pH,若pH大于1,则可证明醋酸为弱电解质 |
| B、用pH计分别测0.01 mol/L和0.10 mol/L的醋酸溶液的pH,若两者的pH相差小于1个单位,则可证明醋酸是弱电解质 |
| C、对盐酸和醋酸溶液进行导电性实验,若与CH3COOH溶液相串联的灯泡较暗,证明醋酸为弱电解质 |
| D、配制0.10 mol/L CH3COONa溶液,测其pH,若常温下pH大于7,则可证明醋酸是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
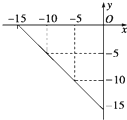 某温度下的溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L.x与y的关系如图所示:
某温度下的溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L.x与y的关系如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com