
| A、用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小 |
| B、物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的 |
| C、对于Al(OH)3(s)?Al(OH)3(aq)?Al3++3OH-,前者为溶解平衡,后者为电离平衡 |
| D、除溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3大 |
| E、沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全 |


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案科目:高中化学 来源: 题型:
| A、①②③④ | B、①② |
| C、②③④ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、BaSO4可做钡餐而BaCO3不能是因为Ksp(BaSO4)<Ksp(BaCO3) |
| B、在制腈纶纤维的1 L溶液中含SO42-为1.0×10-3 mol,则加入0.01 mol BaCl2不能使SO42-完全沉淀 |
| C、在清理有关仪器的BaSO4沉淀时,常加入饱和Na2CO3溶液,使BaSO4转化为BaCO3再用酸处理 |
| D、用稀H2SO4洗涤BaSO4效果比用水好,BaCO3也能用此法处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由溶解性CaCO3<Ca(HCO3)2,则溶解性Na2CO3<NaHCO3 |
| B、向Ca(ClO)2溶液中通入少量CO2可得到CaCO3,则向Ca(ClO)2溶液中通入少量SO2可得到CaSO3 |
| C、由O2与Li加热生成Li2O,则O2与Na加热生成Na2O |
| D、有Fe与S加热生成FeS,则Cu与S加热生成Cu2S |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
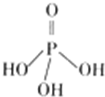 磷单质及其化合物在工业有广泛应用.
磷单质及其化合物在工业有广泛应用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com