
��֪A(g)+B(g) 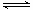 2 C(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
2 C(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
|
�¶�/ �� |
700 |
800 |
830 |
1000 |
1200 |
|
ƽ�ⳣ�� |
1��70 |
1��10 |
1��00 |
0��60 |
0��40 |
�ش��������⣺
��1�� �÷�Ӧ��ƽ�ⳣ������ʽK=______����H_____0���������������=��)��
��2�� �ݻ��̶����жϸ÷�Ӧ�Ƿ�ﵽƽ�������Ϊ (����ȷѡ��ǰ����ĸ)��
a��������ܶȲ���ʱ��ı� b�� c(A)����ʱ��ı�
c���������ƽ����Է�����������ʱ��ı� d�� ѹǿ����ʱ��ı�
��3��1200��ʱ��Ӧ2C(g) 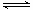 A(g)+B(g)��ƽ�ⳣ����ֵΪ ��
A(g)+B(g)��ƽ�ⳣ����ֵΪ ��
��4��830��ʱ����һ��10��00 L���ܱ������г���0��40mol��A��1��60mol��B�������Ӧ��ʼ2s������C�����ʵ���Ϊ0��40mol����2s��A��ƽ����Ӧ����v(A)= ____mol��L-1��s-1�� 2sʱc(B)= ____ mol��L-1�� 2sʱA��ת����Ϊ____��2sʱC���������Ϊ____��
��1��
 ��1�֣� �� ��1�֣�
��1�֣� �� ��1�֣�
��2��b(1��)
��3��2�� 50(1��)
��4�� 0��010 ��1�֣� 0��14 ��1�֣� 0��50 ��1�֣� 20%��1�֣�
��������
�����������1���¶�Խ�ߣ�ƽ�ⳣ��ԽС�����������¶ȣ�ƽ�������ƶ��������Ƿ��ȷ�Ӧ��
��2�� �ݻ��̶����÷�Ӧ�з�Ӧ��������ﶼ�����壬����һ������������ƽ����������ڵ������ܶȶ�������ʱ��ı䡣��Ӧǰ������ķ�����Ϊ�䣬����һ������Щ��������ƽ����Է�����������ƽ�������ʱ��ı䡣�������ڷ�Ӧǰ�� ���䣬���ѹǿʼ�ղ��䡣
��3����ƽ���ƽ�ⳣ��Ϊ����1200��ʱ��ƽ�ⳣ���ĵ�����
��4���������֪v(C)= 0��02mol��L-1��s-1������v(A)= 0��01mol��L-1��s-1��
A(g) +
B(g) 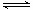 2 C(g)
2 C(g)
��ʼ�� 0��40mol 1��60mol 0
ת���� 0��20mol 0��20mol 0��40mol
ƽ�⣺ 0��20mol 1��40mol 0��40mol
C���������Ҳ����C�����ʵ���������Ϊ: 
���㣺��ѧƽ�⼰ƽ�ⳣ����֪ʶ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 �̷����壨FeSO4?7H2O����ҽҩ������Ѫ����ijͬѧ��KMnO4��Һ�ζ��̷����壨FeSO4?7H2O����Ʒ�����ʲ��� KMnO4��Ӧ��������Ԫ�غ������вⶨ��
�̷����壨FeSO4?7H2O����ҽҩ������Ѫ����ijͬѧ��KMnO4��Һ�ζ��̷����壨FeSO4?7H2O����Ʒ�����ʲ��� KMnO4��Ӧ��������Ԫ�غ������вⶨ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ���Ϻ��г�����������ѧ����ĩ��ѧ�������л�ѧ�Ծ��������棩 ���ͣ������
��֪A(g)+B(g)  C(g)+D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
C(g)+D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
|
�¶�/�� |
700 |
900 |
830 |
1000 |
1200 |
|
ƽ�ⳣ�� |
1.7 |
1.1 |
1.0 |
0.6 |
0.4 |
�ش��������⣺
��1�� 830��ʱ����һ��5 L���ܱ������г���0.20mol��A��0.80mol��B���練Ӧ��ʼ6s��A��ƽ����Ӧ����v(A)=0.003 mol��L-1��s-1����6sʱc(A)��________mol��L-1�� C�����ʵ���Ϊ______ mol����ʱ������Ӧ����_____________������ڡ�����С�ڡ����ڡ����淴Ӧ���ʡ�
��2���ں����ܱ��������жϸ÷�Ӧ�Ƿ�ﵽƽ�������Ϊ________(����ȷѡ��ǰ����ĸ)��
a��ѹǿ����ʱ��ı� b.������ܶȲ���ʱ��ı�
c. c(A)����ʱ��ı� d.��λʱ��������c��D�����ʵ������
��3��1200��ʱ��ӦC(g)+D(g) A(g)+B(g)��ƽ�ⳣ����ֵΪ___________________��
A(g)+B(g)��ƽ�ⳣ����ֵΪ___________________��
��4����������������罻���������ں��ݾ��������£�����2M(g)+N��g�� 2P��g��+Q��s����Ӧ�����±�����Ͷ�ϣ���Ӧ�ﵽƽ��״̬�������ϵѹǿ���ߣ������÷�Ӧ��ƽ�ⳣ�����¶ȵı仯��ϵ��__________________________________________________________________________________��
2P��g��+Q��s����Ӧ�����±�����Ͷ�ϣ���Ӧ�ﵽƽ��״̬�������ϵѹǿ���ߣ������÷�Ӧ��ƽ�ⳣ�����¶ȵı仯��ϵ��__________________________________________________________________________________��
|
�� �� |
M |
N |
P |
Q |
|
��ʼͶ��/mol |
2 |
1 |
2 |
0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ�꺣��ʡ�����и�����ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ������
��֪A(g)+B(g)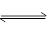 C(g)+D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
C(g)+D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
|
|�¶�/ �� |
700 |
900 |
830 |
1000 |
1200 |
|
ƽ�ⳣ�� |
1.7 |
1.1 |
1.0 |
0.6 |
0.4 |
�ش��������⣺
(1)�÷�Ӧ��ƽ�ⳣ������ʽK= ����H 0���<���� >���� =��)��
(2)830��ʱ����һ��2 L���ܱ������г���0.20mol��A��0.80mol��B���練Ӧ��ʼ6s��A��ƽ����Ӧ����v(A)=0��005 mol��L-1��s-1������6sʱc(A)= mol��L-1�� C�����ʵ���Ϊ mol������Ӧ��һ��ʱ��ﵽƽ��ʱA��ת����Ϊ ��
(3)�жϸ÷�Ӧ�Ƿ�ﵽƽ�������Ϊ (����ȷѡ��ǰ����ĸ)��
a��ѹǿ����ʱ��ı� b��c(A)����ʱ��ı�
c��������ܶȲ���ʱ��ı� d����λʱ��������C��D�����ʵ������
(4)1000��ʱ��ӦC(g)+D(g)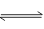 A(g)+B(g)��ƽ�ⳣ����ֵΪ ��
A(g)+B(g)��ƽ�ⳣ����ֵΪ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com