
| A. | 丙烯分子有7个σ键,1个π键 | |
| B. | 由2H和18O所组成的水11g,其中所含的中子数为4NA | |
| C. | 0.1mol SiO2晶体中所含有的硅氧键数目为0.2NA | |
| D. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3mol I2转移的电子数为5NA个 |
分析 A.C-C、C-H键均为σ键,C=C中一个σ键,一个π键;
B.由2H和18O所组成的水的摩尔质量为22g/mol;
C.1mol二氧化硅中含4mol硅氧键;
D.I元素的化合价由+5价降低为0,I元素的化合价由-1价升高为0,转移5e-.
解答 解:A.C-C、C-H键均为σ键,C=C中一个σ键,一个π键,则丙烯分子有8个σ键,1个π键,故A错误;
B.由2H和18O所组成的水的摩尔质量为22g/mol,故11g此水的物质的量为0.5mol,而1mol由2H和18O所组成的水中含12mol中子,故0.5mol水中含6mol中子即6NA个,故B错误;
C.0.1mol二氧化硅中含0.4NA个硅氧键,故C错误;
D.在反应KIO3+6HI=KI+3I2+3H2O中,I元素的化合价由+5价降低为0,I元素的化合价由-1价升高为0,生成3mo1I2转移的电子数为5NA,故D正确;
故选:D.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系是解题关键,注意二氧化硅、丙烯的结构构特点.


科目:高中化学 来源: 题型:选择题
| A. | HS-+H2O?S2-+H3O+ | B. | SO3+H2O?HSO4-+H3O+ | ||
| C. | HCO3-+H2O?CO32-+H3O+ | D. | NH4++2H2O?NH3•H2O+H3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
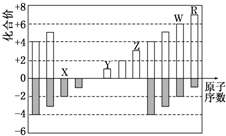
| A. | 原子半径:Z>Y>X | |
| B. | 气态氢化物的稳定性:R>W | |
| C. | WX3和水反应形成的化合物是离子化合物 | |
| D. | Y和Z两者最高价氧化物对应的水化物的碱性:Y<Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 主要成分为NaCl、NaClO和NaHCO3 | B. | c(Cl-)=c(ClO-) | ||
| C. | 2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | D. | c(Na+)=c(Cl-)+c(ClO-)+2c(CO32-)+c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数为12 | B. | 核电荷数为12 | ||
| C. | 电子数为28 | D. | 中子数与质子数之差为16 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 锌是一种重要的金属,锌及其化合物有着广泛的应用.
锌是一种重要的金属,锌及其化合物有着广泛的应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
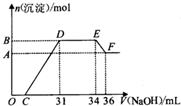 硝酸越稀还原产物中氮元素的化合价越低.某同学取铁铝合金与足量很稀的硝酸充分反应没有气体放出.在反应后的溶液中逐滴加入4mol•L-1 NaOH溶液,所加NaOH溶液的体积与产生的沉淀的物质的量的关系如图.下列说法不正确的是( )
硝酸越稀还原产物中氮元素的化合价越低.某同学取铁铝合金与足量很稀的硝酸充分反应没有气体放出.在反应后的溶液中逐滴加入4mol•L-1 NaOH溶液,所加NaOH溶液的体积与产生的沉淀的物质的量的关系如图.下列说法不正确的是( )| A. | D点溶液中存在:c(NH4+)+c(Na+)+c(H+)=c(OH-)+c(NO3-) | |
| B. | EF段发生化学反应的离子方程式为:Al(OH)3+OH-=Al(OH)4- | |
| C. | 原溶液中n(NH4+)=0.012mol | |
| D. | 溶液中结合OH-能力最强的离子是H+,最弱的离子是Al3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com