
【题目】三元锂电池是以镍、钴、锰为正极材料的新型电池,镍、钴、锰材料可表示为Li1-nNixCoyMnzO2,x+y+z=1,通常简写为Li1-n MO2,Ni、Co、 Mn 三种元素分别显+2、+3、+4价。其充电时总反应为:LiMO2 +C6![]() Li1-nMO2+LinC6,下列说法错误的是
Li1-nMO2+LinC6,下列说法错误的是

A.放电时电子从b电极由导线移向a电极
B.在Li1-nMO2材料中,若x:y:z=2:3:5,则n=0.3
C.放电时,正极反应为:Li1- nMO2+nLi++ne - =LiMO2
D.充电时,当转移0.2mol电子,负极材料减重1.4 g
科目:高中化学 来源: 题型:
【题目】可逆反应2SO2(g)+O2(g)![]() 2SO3(g)△H<0,在一定条件下达到平衡状态,时间为t1时改变条件.化学反应速率与反应时间的关系如图所示.下列说法正确的是( )
2SO3(g)△H<0,在一定条件下达到平衡状态,时间为t1时改变条件.化学反应速率与反应时间的关系如图所示.下列说法正确的是( )
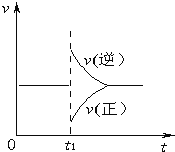
A. 维持温度、容积不变,t1时充入SO3(g)
B. 维持压强不变,t1时升高反应体系温度
C. 维持温度、容积不变,t1时充入一定量Ar
D. 维持温度、压强不变,t1时充入SO3(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关醛的说法正确的是
A.分子通式为CnH2nO的有机物与乙醛一定互为同系物
B.用溴水可以检验CH2=CHCHO中含有的碳碳双键
C.对甲基苯甲醛(![]() )可使酸性KMnO4溶液褪色,说明醛基具有还原性
)可使酸性KMnO4溶液褪色,说明醛基具有还原性
D.能发生银镜反应的有机物不一定是醛类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.有机物A的质谱图和红外光谱图分别如下:

(1)A的结构简式为________。
Ⅱ.相对分子质量不超过100的有机物B,既能与金属钠反应产生无色气体,又能与碳酸钠反应产生无色气体,还可以使溴的四氯化碳溶液褪色。B完全燃烧只生成CO2和H2O。经分析其含氧元素的质量分数为37.21%。经核磁共振检测发现B的氢谱如图:
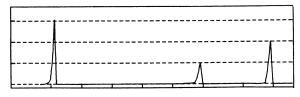
(2)B的结构简式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学利用下图装置(夹持仪器已省略)制备溴苯,并探究该反应原理。
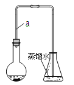
I.制备溴苯
(1)装置中长导管a的作用是______、导出气体,制备溴苯的反应方程式属于______反应,其方程式为________
(2)本实验所获得的溴苯为褐色,是因为________________。
II.分离提纯
已知,溴苯与苯互溶,液溴、苯、溴苯的沸点依次为59℃、80℃、156℃。同学们设计了如下流程:
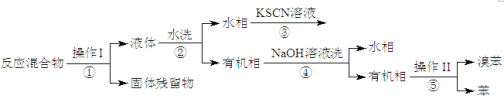
(3)操作Ⅱ为_____________。
(4)流程②和④中,需要用到的玻璃仪器是烧杯、_______;流程③的现象为______,流程④的作用是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将AgNO3溶液分别滴加到浓度均为0.01mol/L的NaBr、Na2SeO3溶液中,所得的沉淀溶解平衡曲线如图所示(Br-、SeO32-用Xn-表示,不考虑SeO32-的水解)。下列叙述正确的是
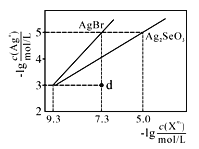
A. Ksp(Ag2SeO3)的数量级为10-10
B. d点对应的AgBr溶液为不饱和溶液
C. 所用AgNO3溶液的浓度为10-3 mol/L
D. Ag2SeO3(s)+2Br-(aq)==2AgBr(s)+SeO32- (aq)平衡常数为109.6,反应趋于完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化石燃料开采、加工过程产生的H2S 废气制取氢气,既价廉又环保。
(1)工业上可用组成为K2O·M2O3·2RO2·nH2O的无机材料纯化制取的氢气。
①已知元素M、R均位于元素周期表中第3周期,两种元素原子的质子数之和为27,则R的原子结构示意图为____________;
②常温下,不能与M单质发生反应的是____________(填序号);
a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(2)利用H2S废气制取氢气的方法有多种。
①高温热分解法已知:H2S(g)![]() H2(g)+1/2S2(g)
H2(g)+1/2S2(g)
在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol·L-1测定H2S的转化率,结果见图。曲线a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。根据图像回答下列问题:
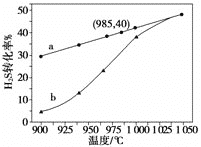
i 计算 985 ℃时H2S按上述反应分解的平衡常数 K=________;
ii 说明随温度的升高,曲线b向曲线a逼近的原因:________________________________;
②电化学法
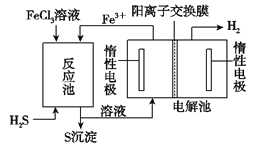
i该法制氢过程如图。反应池中反应物的流向采用气、液逆流方式,其目的是____________;
ii反应池中发生反应的化学方程式为____________;
iii反应后的溶液进入电解池,电解总反应的离子方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示。该温度下,下列说法正确的是
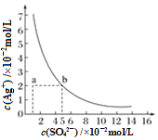
A. 含有大量SO42-的溶液中肯定不存在Ag+
B. Ag2SO4的溶度积常数(Ksp)为1×10-3
C. 0.02 mol·L-1的AgNO3溶液与0.02 mol·L-1的Na2SO4溶液等体积混合不会生成沉淀
D. a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向HCl、AlCl3混合溶液中逐滴加入NaOH溶液,生成沉淀的量随NaOH溶液加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是( )

A. M点对应的溶液中:K+、Fe2+、SO42-、NO3-
B. N点对应的溶液中:K+、NH4+、Cl-、CO32-
C. S点对应的溶液中:Na+、SO42-、HCO3-、NO3-
D. R点对应的溶液中:Na+、SO42-、Cl-、NO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com