
| A. | 1.98g | B. | 2.00g | C. | 2.22g | D. | 2.42g |
分析 98%的浓H2SO4中H2SO4、H2O的物质的量之比为$\frac{0.98}{98}$:$\frac{0.02}{18}$=1:$\frac{1}{9}$,故98%的浓H2SO4可以表示为SO3•$\frac{10}{9}$H2O,吸收SO3后得到H2SO4•SO3,可以表示为2SO3•H2O,进一步表示为$\frac{20}{9}$SO3•$\frac{10}{9}$H2O,计算浓硫酸改写后H2O的物质的量,可得$\frac{20}{9}$SO3•$\frac{10}{9}$H2O的物质的量,再利用硫原子守恒计算H2SO4•$\frac{1}{9}$H2O的物质的量,进而计算其质量,由此分析解答.
解答 解:98%的浓H2SO4中H2SO4、H2O的物质的量之比为$\frac{0.98}{98}$:$\frac{0.02}{18}$=1:$\frac{1}{9}$,故98%的浓H2SO4可以表示为SO3•$\frac{10}{9}$H2O,吸收SO3后得到H2SO4•SO3,可以表示为2SO3•H2O,进一步表示为$\frac{20}{9}$SO3•$\frac{10}{9}$H2O,计算浓硫酸改写后H2O的物质的量,可得$\frac{20}{9}$SO3•$\frac{10}{9}$H2O的物质的量,计算浓硫酸改写后H2O的物质的量,可得$\frac{20}{9}$SO3•$\frac{10}{9}$H2O的物质的量,浓硫酸改写后H2O的物质的量为n(H2O)=1g÷(80+$\frac{10}{9}$×18)×$\frac{10}{9}$=$\frac{1}{90}$mol,则$\frac{20}{9}$SO3•$\frac{10}{9}$H2O的物质的量为0.01mol,根据硫原子守恒,稀释后可得浓硫酸H2SO4•$\frac{1}{9}$H2O的质量为$\frac{0.2}{9}$mol×(98+2)g/mol=2.222g,约是2.22g,
故选:C.
点评 本题考查溶液浓度有关计算,题目过程复杂,为易错题目,关键是明确浓硫酸中水与三氧化硫反应转化为硫酸,注意理解利用改写成化学式形式结合守恒进行解答,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | $\frac{4}{5}$ v(NH3)=v(O2) | B. | $\frac{4}{5}$ v(O2)=v(NO) | C. | $\frac{5}{6}$ v(O2)=v(H2O) | D. | $\frac{2}{3}$ v(NH3)=v(H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NaCl+H2SO4(浓)$\stackrel{加热}{→}$NaHSO4+HCl↑ | |
| B. | 2FeO+4H2SO4(浓) $\stackrel{加热}{→}$Fe2(SO4)3+SO2↑+4H2O | |
| C. | C+2H2SO4(浓) $\stackrel{加热}{→}$CO2↑+2SO2↑+2H2O | |
| D. | 2Al+6H2SO4(浓) $\stackrel{加热}{→}$Al2(SO4)3+3SO2↑+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(O2)=0.0125mol/(L•s) | B. | v(NO)=0.06mol/(L•s) | ||
| C. | v(NH3)=0.002mol/(L•s) | D. | v(H2O)=0.0003mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
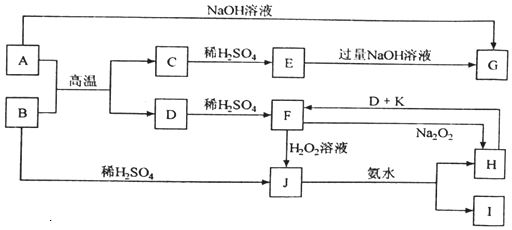
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com