
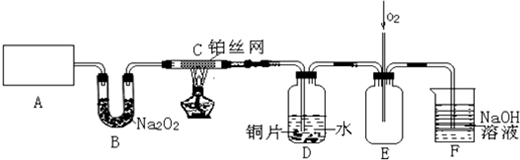
分析 (1)实验室用加热氯化铵和氢氧化钙混合物的方法制备氨气,反应为固体与固体混合加热,用到的玻璃仪器主要为试管和酒精灯;
(2)B装置作用是吸收水蒸气生成氧气;
(3)放热反应开始后,不需要持续加热;硝酸根离子在酸性环境下具有强的氧化性能够氧化铜,增大氢离子浓度能使Cu片溶解的速率加快,可以加入试剂形成原电池加快反应速率,增大离子浓度加快反应速率;
(4)持续通入氧气使一氧化氮气体全部氧化,被氢氧化钠溶液吸收,减少环境污染;
(5)D装置中的液体易发生倒吸,需要在CD之间加一个防倒吸的装置.
解答 解:(1)加热氯化铵和氢氧化钙混合物生成氯化钙、氨气和水,化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;反应为固体与固体加热,用到的玻璃仪器主要为试管和酒精灯2种;
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;2;
(2)B装置是利用过氧化钠吸收氯化铵和氢氧化钙反应生成的水蒸气生成氧气,
故答案为:吸收水蒸气并产生氧气;
(3)撤去C处酒精灯后铂丝能继续保持红热状态,说明该反应为放热反应;
A.Na2CO3 消耗硝酸不能加快铜的反应速率,故A错误;
B.AgNO3 和铜反应生成银,铜和银在稀硝酸溶液中析出原电池加快反应速率,故B正确;
C. H2SO4 会增大氢离子浓度加快铜与稀硝酸的反应速率,故C正确;
D.FeSO4有还原性会消耗硝酸,所以不能加快铜的反应速率,故D错误;
故答案为:BC;
(4)持续通入氧气使一氧化氮气体全部氧化,被氢氧化钠溶液吸收,减少环境污染,故答案为:将产生的NO氧化,充分被NaOH溶液吸收;
(5)D装置中的液体易发生倒吸到C装置,需要在CD之间加一个防倒吸的装置,故答案为:CD之间加一个防倒吸的装置.
点评 本题考查了氨气的制备、性质的检验,熟悉氨气制备原理是解题关键,注意实验装置的作用和注意问题,题目难度中等.


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
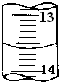 某学生用0.100mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
某学生用0.100mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.288g | B. | 0.366g | C. | 0.384g | D. | 0.396g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com