
| A. | 等物质的量浓度的FeBr2和CuCl2混合溶液用惰性电极电解最初发生:Cu 2++2Br- $\frac{\underline{\;电解\;}}{\;}$Cu+Br2 | |
| B. | Na2S溶液水解:S2-+2H2O?H2S+2OH- | |
| C. | Fe(NO3)3的酸性溶液中通入足量硫化氢:2Fe3++H2S=2Fe2++S↓+2H+ | |
| D. | H218O中投入Na2O2:2H218O+2Na2O2=4Na++4OH-+18O2↑ |
分析 A.阴极上阳离子氧化性强的铜离子先得到电子,阴极上还原性强的溴离子失去电子;
B.硫离子水解分步进行,以第一步为主;
C.硫化氢足量,酸性溶液中,氧化性HNO3>Fe3+,则Fe(NO3)3完全反应;
D.Na2O2为氧化剂,也为还原剂.
解答 解:A.等物质的量浓度的FeBr2和CuCl2混合溶液用惰性电极电解最初发生的离子反应为Cu2++2Br- $\frac{\underline{\;电解\;}}{\;}$Cu+Br2,故A正确;
B.Na2S溶液水解的离子反应为S2-+H2O?HS-+OH-,故B错误;
C.因硫化氢足量,则Fe(NO3)3完全反应,离子反应为Fe3++3NO3-+2H++5H2S═Fe2++3NO↑+6H2O+5S↓,故C错误;
D.H218O中投入Na2O2:的离子反应为2H218O+2Na2O2=4Na++2OH-+218OH-+O2↑,故D错误;
故选A.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重电解、水解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒分析,综合性较强,题目难度不大.


科目:高中化学 来源: 题型:选择题
 喷泉是一种常见的自然现象,其产生的原因是存在压强差,如图所示装置是常见的喷泉实验装置.在圆底烧瓶中分别收集干燥纯净的气体,烧杯和胶头滴管中分别盛放同一种液体.当挤入胶头滴管中液体时,下列实验不能出现喷泉现象的是( )
喷泉是一种常见的自然现象,其产生的原因是存在压强差,如图所示装置是常见的喷泉实验装置.在圆底烧瓶中分别收集干燥纯净的气体,烧杯和胶头滴管中分别盛放同一种液体.当挤入胶头滴管中液体时,下列实验不能出现喷泉现象的是( )| 气 体 | 液 体 | 气 体 | 液 体 | ||
| A | HCl | 蒸馏水 | B | SO2 | 浓烧碱液 |
| C | NO | 浓烧碱液 | D | NH3 | 蒸馏水 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最外层只有1个电子的元素一定是金属元素 | |
| B. | 最外层只有2个电子的元素一定是金属元素 | |
| C. | 原子核外各层电子数相等的元素不一定是金属元素 | |
| D. | 核电荷数为17的元素的原子易获得1个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
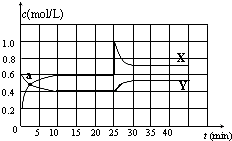 已知NO2和N2O4可以相互转化:N2O4(g)?2NO2(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法不正确的是( )
已知NO2和N2O4可以相互转化:N2O4(g)?2NO2(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法不正确的是( )| A. | 图中的两条曲线,X是表示NO2浓度随时间的变化曲线 | |
| B. | a点时v(N2O4)=v(NO2) | |
| C. | 25min时改变了影响速率的一个因素,使得NO2转变为N2O4,该改变是将密闭容器的体积缩小,增大压强 | |
| D. | 前10min内用v(N2O4)表示的化学反应速率为0.02 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2(g)+0.5O2(g)?SO3(g)△H=-213kJ•mol-1 说明25℃,101kPa下,lmolSO2与0.5mol氧气放入密闭容器中生成SO3时放出213 kJ热量 | |
| B. | 若反应物总能量高于生成物总能量,反应放热,△H<0 | |
| C. | 化学反应必然伴随能量变化 | |
| D. | 酸和碱的中和反应都是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
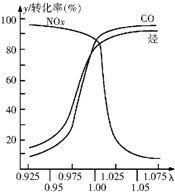 随着经济的发展和生活水平的提高,近年来我省汽车拥有量呈较快增长趋势.
随着经济的发展和生活水平的提高,近年来我省汽车拥有量呈较快增长趋势.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| X | Y | ||
| Z | W | Q |
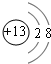 .
.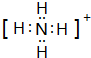 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com