
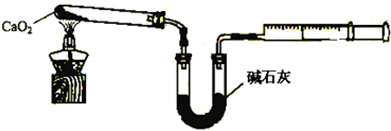
分析 (1)第②步反应中,氯化钙、双氧水、一水合氨和水反应生成CaO2•8H2O和氯化铵;
(2)第①步中氯化铵参加反应、第②步中生成氯化铵,氢氧化钙价格低,H2O2价格较高且易分解;
(3)实验室用硝酸酸化的硝酸银溶液检验;
(4)CaO2能和水反应,氧气能抑制CaO2分解;
(5)根据过氧化钙和氧气之间的关系式计算;
过氧化钙的含量也可用重量法测定,需要测定的物理量有样品质量和反应后固体质量.
解答 解:(1)第②步反应中,氯化钙、双氧水、一水合氨和水反应生成CaO2•8H2O和氯化铵,反应方程式为CaCl2+H2O2+2NH3•H2O+6H2O=CaO2•8H2O↓+2NH4Cl;
故答案为:CaCl2+H2O2+2NH3•H2O+6H2O=CaO2•8H2O↓+2NH4Cl;
(2)第①步中氯化铵参加反应、第②步中生成氯化铵,所以可以循环使用的物质是NH4Cl;
H2O2价格较高且易分解,碱性条件下抑制CaO2•8H2O溶解,所以工业上常采用Ca(OH)2过量而不是H2O2过量的方式来生产;
故答案为:NH4Cl;Ca(OH)2价格低,H2O2价格较高且易分解,碱性条件下抑制CaO2•8H2O溶解;
(3)实验室用硝酸酸化的硝酸银溶液检验,如果沉淀没有洗涤干净,向洗涤液中加入硝酸酸化的硝酸银溶液应该有白色沉淀,其检验方法是:取少量最后一次洗涤上清液,然后向洗涤液中加入少量硝酸酸化的硝酸银溶液,如果产生白色沉淀就证明没有洗涤干净,否则洗涤干净,
故答案为:取少量最后一次洗涤上清液,然后向洗涤液中加入少量硝酸酸化的硝酸银溶液,观察溶液是否产生白色沉淀,如果产生白色沉淀就证明没有洗涤干净,否则洗涤干净;
(4)CaO2能和水反应生成氢氧化钙和氧气,CaO2在350℃迅速分解生成CaO和O2,所以通入氧气能抑制超氧化钙分解;
故答案为:防止过氧化钙和水反应;防止过氧化钙分解;
(5)设超氧化钙质量为x,
2CaO2 $\frac{\underline{\;350°C\;}}{\;}$2CaO+O2↑
144g 22.4L
x 10-3VL
144g:22.4L=x:10-3VL
x=$\frac{144g×1{0}^{-3}VL}{22.4L}$=$\frac{144V}{22400}$g=$\frac{9V}{1400}$g,
其质量分数=$\frac{\frac{9V}{1400}g}{mg}$×100%=$\frac{9V}{1400m}$×100%,
过氧化钙的含量也可用重量法测定,需要测定的物理量有样品质量和反应后固体质量,
故答案为:$\frac{9V}{1400m}$×100%;样品质量和反应后固体质量.
点评 本题考查制备实验方案评价,为高频考点,侧重考查离子检验、化学反应方程式的书写、物质含量测定等知识点,明确实验原理及物质性质是解本题关键,难点是题给信息的挖掘和运用,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{c(O{H}^{-})•c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$ | B. | pH | ||
| C. | NH3•H2O 的电离度 | D. | n(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 75% | B. | 25% | C. | 37.5% | D. | 81% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3(s) | B. | 3.0mol/LHNO3 | C. | CH3COONa(aq) | D. | CuSO4(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 给盛有2/3体积液体的试管加热 | |
| B. | CuSO4溶于水,可将含有CuSO4的废液倒入水槽中,再用水冲入下水道 | |
| C. | 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 | |
| D. | 实验时将剩余的钠放回原试剂瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1000 mL,106 gNa2CO3 | B. | 950 mL,101.8 g Na2CO3 | ||
| C. | 500 mL,286 g Na2CO3?10H2O | D. | 1000 mL,101.8 g Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com