
【题目】25 ℃时,CH3COOH的电离平衡常数Ka=1.75×10-5,NH3·H2O的电离平衡常数Kb=1.75×10-5,现在25 ℃时向10 mL浓度均为0.1 mol·L-1的HCl和CH3COOH的混合溶液中逐滴加入0.1 mol·L-1的氨水,溶液的pH变化曲线如图所示。下列有关说法不正确的是( )
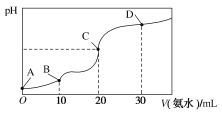
A.A点到B点,溶液的导电性逐渐减小
B.整个过程中,C点处水的电离程度最大
C.pH =7时对应的点应在C点和D点之间,此时溶液中存在:c(NH4+)=c(CH3COO-)+c(CH3COOH)
D.D点处:c(NH4+)>c(Cl-)>c(CH3COO-)>c(OH-)>c(H+)
【答案】C
【解析】
A、HCl和CH3COOH的混合溶液中,HCl先与氨水反应,则A点到B点,盐酸与氨水反应生成氯化铵,随着氨水加入,离子数目不变,但溶液体积增大,离子浓度减小,所以溶液导电性逐渐减小,故A正确;
B、C点时氨水与HCl、CH3COOH的混合溶液恰好完全反应,此时溶质是氯化铵、醋酸铵,盐水解促进水电离,所以C点水的电离程度最大,故B正确;
C、C点溶液为等物质的量浓度的NH4Cl、CH3COONH4的混合溶液,NH4Cl水解呈酸性,由于NH4+的水解程度等于CH3COO-的水解程度,醋酸铵水解呈中性,所以C点溶液呈酸性,D点溶液为等物质的量浓度的NH3·H2O、NH4Cl、CH3COONH4的混合溶液,由于NH3·H2O的电离程度大于NH4+的水解程度,D点溶液呈碱性,故在C点和D点之间某处存在溶液pH=7时对应的点,根据电荷守恒可知,该点溶液中存在:c(NH4+)+c(H+)=c(CH3COO-)+c(Cl-)+c(OH-),又c(H+)=c(OH-),则c(NH4+)=c(CH3COO-)+c(Cl-),由于c(Cl-)>c(CH3COOH),故c(NH4+)>c(CH3COO-)+c(CH3COOH),故C错误;
D、由上述分析可知,D点溶液为等物质的量浓度的NH3·H2O、NH4Cl、CH3COONH4的混合溶液,D点呈碱性, D点处溶液中c(NH4+)>c(Cl-)>c(CH3COO-)>c(OH-)>c(H+),故D正确。


 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:
【题目】双羟基铝碳酸钠是医疗上常用的一种抑酸剂,其化学式是NaAl(OH)2CO![]() 。关于该物质的说法正确的是( )
。关于该物质的说法正确的是( )
A. 该物质属于两性氢氧化物
B. 该物质是Al(OH)3和Na2CO3的混合物
C. 1 mol NaAl(OH)2CO3最多可消耗3 mol H![]()
D. 该药剂不适合于胃溃疡患者服用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年10月23日,十九大新闻中心在梅地亚举行以“践行绿色发展理念,建设美丽中国”为主题的记者招待会,聚焦环保话题。绿色化学是“预防污染”的根本手段,它的目标是研究和寻找能充分利用的无毒害原材料,最大限度地节约能源,在化工生产各个环节中都实现净化和无污染。
(1)在我国西部大开发中,某省为筹建一大型化工基地,征集到下列方案,其中你认为可行的是________。
A 建在西部干旱区可以脱贫致富
B 应建在水资源丰富和交通方便且远离城市的郊区
C 企业有权自主选择厂址
D 不宜建在人稠密的居民区
(2)某化工厂排放的污水中含有![]() 、
、![]() 、
、![]() 、
、![]() 四种离子。甲、乙、丙三位学生分别设计了从该污水中回收纯净的金属铜的方案。
四种离子。甲、乙、丙三位学生分别设计了从该污水中回收纯净的金属铜的方案。
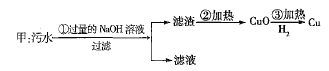
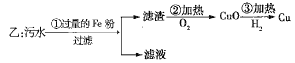
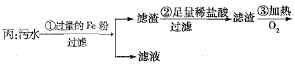
![]()
在能制得纯铜的方案中,哪一步操作会导致环境污染?_______。应增加什么措施防止污染?_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁(FeC2O4)可作为生产电池正极材料磷酸铁锂的原料,受热容易分解,为探究草酸亚铁的热分解产物,按下面所示装置进行实验。
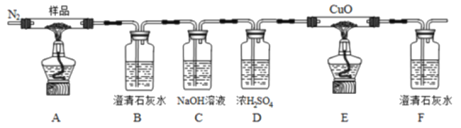
下列说法不正确的是
A.实验中观察到装置B、F中石灰水变浑浊,E中固体变为红色,则证明分解产物中有CO2和CO
B.反应结束后,取A中固体溶于稀硫酸,向其中滴加1~2滴KSCN溶液,溶液无颜色变化,证明分解产物中不含Fe2O3
C.装置C的作用是除去混合气中的CO2
D.反应结束后,应熄灭A,E处酒精灯后,持续通入N2直至温度恢复至室温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。某同学为了确认其成分,取部分试液,设计并完成了如下实验,由此可知原溶液中
。某同学为了确认其成分,取部分试液,设计并完成了如下实验,由此可知原溶液中![]()
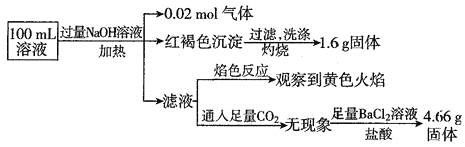
A.原溶液中![]()
B.要确定原溶液中是否含有![]() ,其操作为:取少量原溶液于试管中,加KSCN溶液,再加入适量氯水,溶液呈血红色,则含有
,其操作为:取少量原溶液于试管中,加KSCN溶液,再加入适量氯水,溶液呈血红色,则含有![]()
C.![]() 、
、![]() 、
、![]() 一定存在,
一定存在,![]() 、
、![]() 一定不存在
一定不存在
D.溶液中至少有4种离子存在,其中![]() 一定存在,且
一定存在,且![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1mol有机化合物A与标准状况下5.6L氧气混合,一定条件下两者完全反应,只有CO、CO2和H2O三种产物,将全部产物依次通入足量的浓硫酸和碱石灰中,浓硫酸增重5.4克,碱石灰增重4.4克,还有标准状况下2.24L气体的剩余,求:
(1)有机化合物A的分子式_______(要求写出推理过程);
(2)若有机化合物A能与钠反应放出氢气,请写出A的结构简式_________;
(3)写出所有比A多一个—CH2—原子团的同系物的结构简式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种有机化合物,其结构简式如下,下列有关它的性质叙述中,正确的是( )
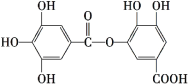
A.酸性条件下 能发生水解反应,水解后能生成两种物质
B.在一定条件下,1 mol该物质最多能与7 mol NaOH完全反应
C.在一定条件下,1 mol该物质可以和8 mol H2发生加成反应
D.有弱酸性,能与NaHCO3溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知煤的部分结构模型如图所示:

(1)我国大约70%的煤是直接用于燃烧的。从煤的结构模型来看,在提供热量的同时产生大量的________等气体物质,造成严重的大气污染。
(2)“型煤”技术不仅可以减少87%的废气排放量,烟尘排放量也可减少80%,致癌物3.4-苯并芘的排放量也减少,同时节煤20%~30%。“型煤”技术的原理是利用固硫剂在燃烧过程中生成稳定的硫酸盐。下列物质中适宜作固硫剂的有________(填字母)。
A.氯化钙 B.氧化钙 C.硫酸钙 D.氢氧化钙
(3)某“型煤”生产厂利用石灰石作固硫剂,试用化学方程式表示其“固硫”过程:_____________________________________________________________。
(4)除上述的“型煤”技术外,为了解决煤燃烧所造成的污染问题和提高煤的利用价值,煤资源的综合利用方法还有________、________、________等。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,用NaOH调节0.10mol/LH2C2O4溶液的pH,假设不同pH下均有c(H2C2O4)+c(HC2O4—)+c(C2O42-)=0.10mol/L。使用数字传感器测得溶液中各含碳微粒的物质的量浓度随pH的变化曲线如下图。下列有关分析正确的是

A. 曲线a代表H2C2O4浓度随pH的变化
B. pH从4到6时主要发生的反应离子方程式为2OH-+H2C2O4====2H2O+C2O42-
C. 在曲线a、c交界点有:c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-)
D. 当溶液pH=7时:c(Na+)>c(C2O42-)>c(HC2O4-)>c(H2C2O4)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com