
| 次数 | 第1次 | 第2次 |
| 加入稀盐酸的质量/g | 50 | 50 |
| 剩余固体的质量/g | 2.6 | 1 |
分析 (1)Mg与盐酸反应,而Cu不与盐酸反应,加入第1次50g盐酸溶解Mg为50g-2.6g=2.4g,第2次加入50g盐酸溶解Mg为2.6g-1g=1.6,第2次加入的盐酸有剩余,剩余的1g为Cu;
(2)50g盐酸可以溶解2.4g Mg,根据Mg+2HCl=MgCl2+H2↑计算HCl的质量,进而计算盐酸中溶质的质量分数.
解答 解:(1)Mg与盐酸反应,而Cu不与盐酸反应,加入第1次50g盐酸溶解Mg为50g-2.6g=2.4g,第2次加入50g盐酸溶解Mg为2.6g-1g=1.6,第2次加入的盐酸有剩余,剩余的1g为Cu,则合金中Mg的质量为5g-1g=4g,
故答案为:4;
(2)50g盐酸可以溶解2.4g Mg,设HCl的质量为m,则:
Mg+2 HCl=MgCl2+H2↑
24 73
2.4g m
所以m=$\frac{2.4g×73}{24}$=7.3g
故盐酸的质量分数为$\frac{7.3g}{50g}$×100%=14.6%
答:盐酸的质量分数为14.6%.
点评 本题考查混合物的有关计算,关键是明确发生的反应,根据表中数据判断过量问题,侧重考查学生分析问题能力,需要学生具备扎实的基础与灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 强电解质都易溶于水,所以BaSO4是弱电解质 | |
| B. | 一定条件下醋酸溶液的导电能力可能比稀硫酸强 | |
| C. | SO2的水溶液能导电,所以SO2是电解质 | |
| D. | 金刚石不导电,因此金刚石是非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种气体都是无色有毒的气体,且都可用水吸收以消除对空气的污染 | |
| B. | 二氧化硫与过量的二氧化氮混合后通入水中能得到两种常用的强酸 | |
| C. | 两种气体都具有强氧化性,因此都能够使品红溶液褪色 | |
| D. | 两种气体溶于水都可以与水反应,且只生成相应的酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 缩小体积使压强增大 | B. | 体积不变充入稀有气体使压强增大 | ||
| C. | 体积不变充入He使压强增大 | D. | 压强不变充入稀有气体氖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
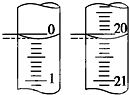 某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液.
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液.| 滴定次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.20 | 20.22 | |
| 第二次 | 25.00 | 0.56 | 24.54 | |
| 第三次 | 25.00 | 0.42 | 20.40 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前度数(mL) | 滴定后度数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
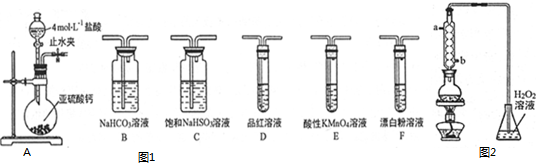
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | ①能使溴的四氯化碳溶液褪色; ②比例模型为:  ③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成; ②球棍模型为: 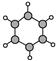 |
| C | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与E反应生成相对分子质量为100的酯. |
| D | ①相对分子质量比C少2; ②能由C氧化而成; |
| E | ①由C、H、O三种元素组成; ②球棍模型为: 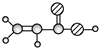 |
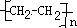 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com