HNO
3是极其重要的化工原料.工业上制备HNO
3采用NH
3催化氧化法,将中间产生的NO
2在密闭容器中多次循环用水吸收制备的.
(1)工业上用水吸收NO
2生产硝酸,生成的尾气经过多次氧化、吸收的循环操作使其充分转化为硝酸(假定上述过程中无其它损失).
①试写出上述反应的化学方程式______.
②设循环操作的次数为n次,试写出NO
2→HNO
3转化率a与循环次数n之间关系的数学关系式.______.
(2)用上述方法制备的HNO
3为稀HNO
3,将它用水稀释或蒸馏、浓缩可制得不同浓度的HNO
3.实验证明:不同浓度的HNO
3与同一金属反应可生成不同的还原产物.例如镁与硝酸反应实验中,测得其气相产物有H
2、N
2、NO、NO
2,液液中有Mg(NO
3)
2、NH
4NO
3和H
2O.生成这些产物的HNO
3浓度范围为:H
2:c<6.6mol/L;N
2和NH
4+:c<10.0mol/L;NO:0.10mol/L<c<10.0mol/L;NO
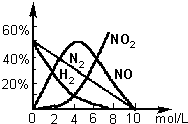
2:c>2.0mol/L.各气体产物成分及含量随HNO
3的浓度变化曲线如图所示.
①写出Mg与12mol/L的HNO
3反应的化学方程式______.
②480mgMg与0.50L4.0mol/L的HNO
3充分反应,收集到112mL气体(SPT).试通过计算写出反应化学方程式.______.