
(1)O=C=C=C=O
(2)C5O2
(3)能;C3O2+2O2 3CO2
3CO2
(4)加成
(5)O=C=C=C=O+2NH3→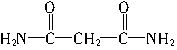
O=C=C=C=O+2HCl→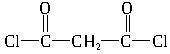


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:河北省秦皇岛一中2008-2009学年高一下学期第二次月考化学试题 题型:022
碳的稳定的氧化物除CO、CO2外,还有C3O2、C4O3、C5O2、C12O9等低氧化物,其中C3O2是一种在常温下有恶臭的气体,其分子中的每个原子都满足最外层8个电子结构.
(1)C3O2分子的电子式为________,分子空间构型为________型;
(2)在上述碳的低氧化物中,若有分子空间构型与C3O2相同的,最可能是________
查看答案和解析>>
科目:高中化学 来源:福建省厦门六中2010-2011学年高二下学期期中考试化学试题 题型:022
碳是组成物质种类最多的元素.
(1)碳元素在元素周期表中的位置是第________周期________族.
碳有612C、613C、614C三种原子,它们互称为________.
(2)金刚石、石墨、C60三种碳单质互称为________.
C60的晶体类型是________,金刚石中碳原子的轨道杂化方式是________,石墨晶体中存在的作用力有________.
(3)利用碳的低价氧化物CO可以合成化工原料COCl、配合物Fe(CO)5等.
①COCl分子的结构式为![]() ,分子中C原子的杂化轨道方式是________;按原子轨道重叠方式判断COCl分子中的化学键类型为________.
,分子中C原子的杂化轨道方式是________;按原子轨道重叠方式判断COCl分子中的化学键类型为________.
②Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂.据此可判断Fe(CO)5的晶体类型为________;Fe(CO)5在一定条件下发生分解反应:Fe(CO)5![]() Fe(s)+5CO,反应过程中,断裂的化学键只有配位键.形成的化学键是________.
Fe(s)+5CO,反应过程中,断裂的化学键只有配位键.形成的化学键是________.
金属铁单质的晶体在不同温度下有两种堆积方式,晶胞如图所示.体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为________.

查看答案和解析>>
科目:高中化学 来源: 题型:
(1)C3O2分子的结构式为 ,分子空间构型为型 ;
(2)在上述碳的氧化物中,若有与C3O2的分子构型相同的,则最有可能的是 ;
(3)不考虑反应条件,根据你现有的化学知识判断,C3O2 (填“能”或“不能”)与H2O发生反应,如能,请将能够反应的化学方程式写在下面: 。
查看答案和解析>>
科目:高中化学 来源:2012届福建省高二下学期期中考试化学试卷 题型:填空题
(11分)碳是组成物质种类最多的元素。
(1)碳元素在元素周期表中的位置是第 周期 族。
碳有612C、613C、614C三种原子,它们互称为 。
(2)金刚石、石墨、C60三种碳单质互称为 。
C60的晶体类型是 ,金刚石中碳原子的轨道杂化方式是 ,
石墨晶体中存在的作用力有 。
(3)利用碳的低价氧化物CO可以合成化工原料COCl、配合物Fe(CO)5等。
①COCl分子的结构式为 ,分子中C原子的杂化轨道方式是_____________;按原子轨道重叠方式判断COCl分子中的化学键类型为___________________。
,分子中C原子的杂化轨道方式是_____________;按原子轨道重叠方式判断COCl分子中的化学键类型为___________________。
②Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂。据此可判断Fe(CO)5的晶体类型为 ;Fe(CO)5在一定条件下发生分解反应:Fe(CO)5 ==Fe(s)+5CO,反应过程中,断裂的化学键只有配位键。形成的化学键是_______________。
金属铁单质的晶体在不同温度下有两种堆积方式,晶胞如图所示。体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com