

分析 (1)增大反应物浓度、使用催化剂、升高温度等均可加快反应速率;
(2)放热反应中反应物的总能量大于生成物的总能量;
(3)H元素的化合价升高,则氢气在负极失去电子,发生氧化反应,反应中消耗2molH2转移4mol电子,以此解答;
(4)①根据曲线的变化趋势判断反应物和生成物,根据物质的量变化之比等于化学计量数之比书写方程式;
②根据v=$\frac{△c}{△t}$计算反应速率;
③在相同温度下,气体的物质的量之比等于压强之比;根据摩尔质量M=$\frac{m}{n}$判断.
解答 解:(1)A.使用催化剂,加快反应速率,故A选;
B.适当提高氧气的浓度,反应物浓度增大,反应速率加快,故B选
C.适当提高反应的温度,反应速率加快,故C选;
D.适当降低反应的温度,反应速率减慢,故D不选;
故答案为:ABC;
(2)由图可知,A中反应物的总能量大于生成物的总能量,为放热反应,
故答案为:A;
(3)H元素的化合价升高,则氢气在负极失去电子,发生氧化反应,反应中消耗2molH2转移4mol电子,则电路中每转移0.2mol电子,标准状况下消耗H2的体积是0.1mol×22.4L/mol=2.24L,
故答案为:负;氧化;2.24;
(4)①由图象可以看出,X、Y的物质的量逐渐减小,Z的物质的量逐渐增大,则X、Y为反应物,Z为生成物,2min后,X、Y的物质的量为定值且不为零,为可逆反应,相同时间内物质的量的变化比值为:△n(X):△n(Y):△n(Z)=(1.0-0.7)mol:(1.0-0.9)mol:0.2mol=3:1:2,则化学方程式为3X+Y?2Z,
故答案为:3X+Y?2Z;
②反应开始至2min,气体Z的平均反应速率为v=$\frac{0.2mol}{\frac{2L}{2min}}$=0.05mol/(L•min),
故答案为:0.05mol/(L•min);
③反应达平衡时,气体的总物质的量为:0.9mol+0.7mol+0.2mol=1.8mol,
起始时气体的总物质的量为:1.0mol+1.0mol=2.0mol,
反应达平衡时,此时容器内的压强与起始压强之比为1.8mol:2.0mol=9:10,此时体系的压强是开始时的 0.9倍
平衡时,混合气体的平均摩尔质量为$\overline{M}$=$\frac{m总}{n总}$,气体的总质量不变,总物质的量减少,混合气体的平均摩尔质量增大,
故答案为:0.9;增大.
点评 本题考查较综合,涉及化学反应速率的影响因素、化学键及反应中能量变化、原电池、化学平衡的变化图象等,为高频考点,侧重化学反应原理的考查,注意化学方程式的确定方法,以及反应速率计算,把握好相关概念和公式的理解及运用,题目难度不大.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 蛋白质溶液中加Na2SO4可使其变性 | |
| B. | 乙烷、苯、葡萄糖溶液均不能使酸性KMnO4溶液褪色 | |
| C. | 有机物CH2=CHCH(CH3)Cl能发生加成反应、取代反应、缩聚反应、氧化反应 | |
| D. | 分子式为C4H7ClO2且能与NaHCO3反应放出气体的有机物结构有5种(不包含立体异构) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、K+、OH-、NO3- | B. | NH4+、Cu2+、SO42-、Cl- | ||
| C. | Al3+、Fe2+、SO42-、NO3- | D. | Na+、Ca2+、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V${\;}_{C{O}_{2}}$(标况) | 2.24L | 3.36L | 3.36L |
| A. | 盐酸的物质的量浓度为5.0mol•L-1 | |
| B. | 根据表中数据计算出混合物中NaHCO3的物质的量分数为45.7% | |
| C. | 9.2g混合物中NaHCO3和KHCO3分别为5.0g和4.2g | |
| D. | 15.7g混合物恰好与盐酸完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
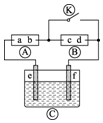 如图为直流电源,?为浸透饱和碘化钾溶液和淀粉溶液的滤纸,?为电镀槽.接通电路后发现?上的d点显蓝色.为实现铁上镀锌,接通
如图为直流电源,?为浸透饱和碘化钾溶液和淀粉溶液的滤纸,?为电镀槽.接通电路后发现?上的d点显蓝色.为实现铁上镀锌,接通 后,使c、d两点短路.下列叙述不正确的是( )
后,使c、d两点短路.下列叙述不正确的是( )| A. | f电极为锌板 | B. | c极发生的反应为2H++2e-═H2↑ | ||
| C. | a为直流电源的正极 | D. | e极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “凡造竹纸…用上好石灰化汁涂浆”,造纸利用了石灰的碱性 | |
| B. | “曾青(硫酸铜)涂铁,铁赤色如铜”,过程中发生了罝换反应 | |
| C. | 人民币防伪荧光油墨由颜料与树脂连接料等制成,其中树脂属于有机高分子材料 | |
| D. | 含钙镁离子的硬水均可通过煮沸的方法使之软化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | 向NaAlO2溶液中滴入NaHCO3溶液 | 有白色沉淀生成 | AlO2-结合H+的能力比CO32-强 |
| B | 向某溶液中滴入氯水,再滴加KSCN溶液 | 溶液显血红色 | 原溶液中一定有Fe2+ |
| C | 向某无色溶液中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中一定无NH4+ |
| D | 用洁净的铂丝蘸取某溶液进行焰色反应 | 火焰呈黄色 | 原溶液中一定有Na+、无K+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com