
还原沉淀法是处理含铬(含Cr2O72﹣和CrO42﹣)工业废水的常用方法,过程如下:
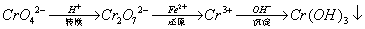
己知转化过程中反应为:2CrO42﹣(aq)+2H+(aq)  Cr2O72﹣(aq)+H2O(1)。转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣。下列说法不正确的是
Cr2O72﹣(aq)+H2O(1)。转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣。下列说法不正确的是
A.若用绿矾(FeSO4·7H2O)(M=278)作还原剂,处理1L废水,至少需要917.4g
B.溶液颜色保持不变,说明上述可逆反应达到达平衡状态
C.常温下转换反应的平衡常数K=1×1014,则转化后所得溶液的pH=6
D.常温下Ksp[Cr(OH)3]=1×10﹣32,要使处理后废水中c(Cr3+)降至1×10﹣5mol/L,应调溶液的pH=5
科目:高中化学 来源: 题型:
向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,溶液变为棕色。再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色。下列分析正确的是
A.滴加KI溶液时,转移2 mol电子时生成1 mol白色沉淀
B.通入SO2后溶液逐渐变成无色,体现了SO2的漂白性
C.通入SO2时,SO2与I2反应,I2作还原剂
D.上述实验条件下,物质的氧化性:Cu2+>I2>SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上从4J29合金(铁钴镍合金)废料中提取钴和镍,一般先用硫酸溶解合金使之成为
Fe2+、Co2+、Ni2+,再把Fe2+氧化为Fe3+,从而使Fe3+转化为某种沉淀析出,达到与Ni2+、Co2+分离的目的。生产上要使Fe2+氧化为Fe3+,而不使Co2+、Ni2+被氧化的试剂是NaClO或NaClO3(均含少量H2SO4)溶液,反应的部分化学方程式如下(A为还原剂):
NaClO+A+B―→NaCl+C+H2O
NaClO3+A+B―→NaCl+C+H2O
(1)请完成以上化学方程式:_______________________________________________,
________________________________________________________________________。
实际生产中采用NaClO3来氧化Fe2+比较合算,其理由是
________________________________________________________________________。
(2)配平下列离子方程式,并回答问题。
 Fe(OH)3+
Fe(OH)3+ ClO-+
ClO-+ OH-===
OH-=== FeO
FeO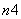 +
+ Cl-+
Cl-+ H2O
H2O
(3)已知有3.21 g Fe(OH)3参加反应,共转移了5.418×1022个电子,则n=________。
(4)根据上述(2)(3)题推测FeO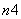 能与下列哪些物质反应________(只填序号)。
能与下列哪些物质反应________(只填序号)。
A.Cl2 B.SO2 C.H2S D.O2
查看答案和解析>>
科目:高中化学 来源: 题型:
在体积不变的密闭容器中,2A(g)+2B(g) 3C(g)+D(g)达到平衡状态的标志是.
3C(g)+D(g)达到平衡状态的标志是.
A.单位时间内生成2n mol A,同时生成n mol D
B.容器内压强不随时间而变化
C.单位时间内生成n mol B,同时消耗1.5n mol C
D.容器内混合气体密度不随时间而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法正确的是
A.常温下,0.05 mol·L-1Fe2(SO4)3溶液中含Fe3+数目小于0.1 NA
B.30g甲醛中含电子对数为4NA
C.12 g石墨烯(单层石墨)中含有六元环的个数是0.5NA
D.室温下,7.1 g氯气与足量石灰乳充分反应转移电子数小于0.1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
高分子化合物G是作为锂电池中 Li+ 迁移的介质,合成G的流程如下:

已知:①
②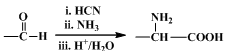
(1)D的官能团名称是 。
(2)A→B的反应类型是 。
(3)C的结构简式是 。
(4)D→E反应条件是 。
(5)G的结构简式是 。
(6)已知:

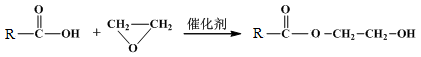
M→N的化学方程式是 。
(7)D的同分异构体中,写出有顺反异构的结构简式
注意:①两个羟基连在同一个碳上,羟基连在双键的碳上的结构不稳定都不予考虑。
②不考虑过氧键和环状结构 ③顺反结构均写出
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于常温下,pH=3的醋酸溶液(I)和 pH=11的氢氧化钠溶液(Ⅱ)的说法正确的是( )
A.I和Ⅱ的物质的量浓度均为0.001mol·L-1
B.将I稀释10倍,溶液中 c(CH3COOH)、 c(OHˉ)均减小
C.I和Ⅱ溶液混合,若c(OH-)>c(H+),则氢氧化钠过量
D.I和Ⅱ等体积混合后,溶液中离子浓度大小为c(CH3COO-)>c(Na+)> c(H+)> c(OH--)
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器内,可逆反应: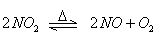 ,达到平衡状态的标志是:
,达到平衡状态的标志是:
(1)单位时间内生成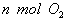 的同时生成
的同时生成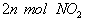
(2)单位时间内生成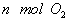 的同时生成
的同时生成
(3)用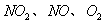 的物质的量浓度变化表示反应速率的比为2:2:1的状态
的物质的量浓度变化表示反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态
(5)混合气体的平均相对分子质量不再改变的状态
A. (1)(3)(4) B. (2)(3)(5)
C. (1)(4)(5) D. (1)(2)(3)(4)(5)
查看答案和解析>>
科目:高中化学 来源: 题型:
将等物质的量的镁和铝混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是 ( )
A.3 mol·L-1 HCl B.4 mol·L-1 HNO3
C.8 mol·L-1 NaOH D.18 mol·L-1 H2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com