
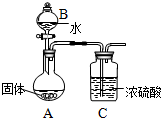
 镁在空气中燃烧除生成MgO外,还可能生成Mg3N2.某校化学兴趣小组的同学利用镁在空气中燃烧后的固体(不含单质)进行实验,探究其组成.
镁在空气中燃烧除生成MgO外,还可能生成Mg3N2.某校化学兴趣小组的同学利用镁在空气中燃烧后的固体(不含单质)进行实验,探究其组成.| 100×ag |
| 34 |
| 50a |
| 17 |
| 50a |
| 17 |
| 100g×0.08g |
| 20g |
| 0.4g |
| 4.0g |
| ||
| ||


科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
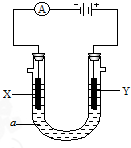 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
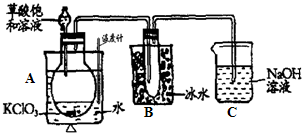
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
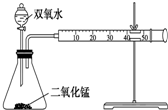 某化学实验小组为确定过氧化氢分解的最佳催化条件,用如图装置进行实验,反应物用量和反应停止的时间数据如下表:
某化学实验小组为确定过氧化氢分解的最佳催化条件,用如图装置进行实验,反应物用量和反应停止的时间数据如下表:| MnO2 时间 H2O2 | 0.1 g | 0.3 g | 0.8 g |
| 10 mL 1.5% | 223 s | 67 s | 56 s |
| 10 mL 3.0% | 308 s | 109 s | 98 s |
| 10 mL 4.5% | 395 s | 149 s | 116 s |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | X | T | Z |
| 初始浓度/mol?L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol?L-1 | 0.05 | 0.05 | 0.1 |
| A、反应达到平衡时,X的转化率为50% |
| B、反应可表示为X+3Y?2Z,其平衡常数为1600(mol/L)-2 |
| C、改变温度可以改变此反应的平衡常数 |
| D、增大压强使平衡向生成Z的方向移动,平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
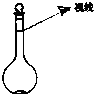 实验室里需用480mL 0.1mol?L-1的硫酸铜溶液.试回答该溶液配制过程中的下列问题:
实验室里需用480mL 0.1mol?L-1的硫酸铜溶液.试回答该溶液配制过程中的下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4:7 | B、10:7 |
| C、14:11 | D、11:14 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com