
【题目】绿色化学提倡化工生产应提高原子利用率。原子利用率表示目标产物的质量与生成物总质量之比。在下列用氨气氮肥的制备反应中,原子利用率最高的是
A.NH3+NaCl+H2O+CO2=NaHCO3+NH4Cl
B.2NH3+CO2=2H2O+CO(NH2)2
C.8NH3+3Cl2=N2+6NH4Cl
D.NH3+HCl=NH4Cl
 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】以Pt为电极,电解含有0.10molM+和0.10molN3+(M+、N3+均为金属阳离子)的溶液,阴极析出金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如右图。对离子氧化能力的强弱判断正确的是(选项中H+为氢离子)

A. M+>H+>N3+
B. M+>N3+>H+
C. N3+>H+>M+
D. 条件不足,无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不正确的是
A.石英坩埚、水泥、陶瓷都是硅酸盐产品
B.水晶、玛瑙的主要成分都是SiO2
C.二氧化硅能与氢氟酸反应,可利用此原理刻蚀玻璃
D.二氧化硅和大多数硅酸盐的化学性质都很稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁片与稀硫酸反应制取氢气是,下列的措施中,不能使氢气生成速率加快的是
A. 加热B. 不用稀硫酸,改用98﹪浓硫酸
C. 滴加少量硫酸铜溶液D. 不用铁片,改用铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中D形成的两种氧化物都是大气污染物。下列有关判断正确的是 ( )。

A. 简单氢化物的热稳定性:C>A
B. 最高价氧化物对应水化物的酸性:D<C
C. B的最高价氧化物的水化物能与C的最高价氧化物的水化物反应
D. A、C、D的含氧酸的钠盐水溶液可能均显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+![]() O2(g)===CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
O2(g)===CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
CO(g)+![]() O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
H2(g)+![]() O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
则CO(g)+2H2(g) ![]() CH3OH(g) ΔH=________kJ·mol-1
CH3OH(g) ΔH=________kJ·mol-1
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是________(填写序号).
a.使用高效催化剂 b.降低反应温度
c.增大体系压强 d.不断将CH3OH从反应混合物中分离出来
(3)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,
在催化剂作用下反应生成甲醇,
平衡转化率与温度、压强的关系如图所示。
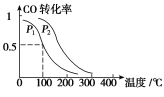
①p1________p2(填“大于”、“小于”或“等于”);
②100 ℃时,该反应的化学平衡常数K=________(mol·L-1)-2;
③在其它条件不变的情况下,再增加a mol CO和2a molH2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”)。
(4)某科研小组用SO2为原料制取硫酸。
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池的负极的电极反应式________________。
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下图所示。
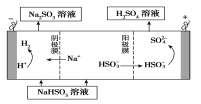
请写出开始时阳极反应的电极反应式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下(金属单质E可由滤液C制取):已知:Cu2O+2H+===Cu2++Cu+H2O。

(1)滤液A中铁元素的可能存在形式为________(填离子符号),与之相关的离子方程式为 ; 。
若滤液A中存在Fe3+,检验该离子的试剂为________(填试剂名称)。
(2)写出E和F反应生成铜的化学方程式为 。
(3)利用电解法进行粗铜精炼时,下列叙述正确的是________(填序号)。
a.若用硫酸铜溶液作电解液,![]() 向阴极移动
向阴极移动
b.粗铜接电源正极,发生还原反应
c.精铜作阴极,电解后电解液中Cu2+浓度减小
d.当粗铜消耗6.4 g时,转移0.2NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知浓硫酸与乙醇的混合液加热后可产生乙烯.为探究乙烯与溴的加成反应,甲同学设计并进行了如下实验:将生成的气体通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应。
乙同学在甲同学的实验中,发现褪色后的溶液中有硫酸根离子,推测在制得的乙烯中还可能有少量还原性气体杂质,由此他提出必须先除去之,再与溴水反应。
请回答下列问题:
(1)甲同学实验中溴水褪色的主要方程式为_________________________________________________。
(2)甲同学设计的实验_____________________(填能或不能)验证乙烯与溴水发生加成反应,理由是_____________________________________。
A、使溴水褪色的反应未必是加成反应。
B、使溴水褪色的反应就是加成反应。
C、使溴水褪色的物质未必是乙烯。
D、使溴水褪色的物质就是乙烯。
(3)乙同学推测乙烯中必定含有的一种气体是SO2,可以用________________________来验证,它与溴水反应的化学方程式是_______________________________________________。
(4)为验证这一反应是加成而不是取代,丙同学提出可用pH 试纸来测试反应后溶液的酸性,理由是______________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于Fe(OH)3胶体的说法中不正确的是:
A. Fe(OH)3胶体与食盐溶液混合将产生聚沉现象
B. Fe(OH)3胶体粒子在电场影响下将向阳极移动
C. 胶体中Fe(OH)3胶体粒子不停地作布朗运动
D. 光线通过Fe(OH)3胶体时会发生丁达尔效应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com