
| 元素代号 | 部分特征 |
| A | 气态单质在标准状况下密度是0.0893g/L |
| B | 形成的化合物的种类最多 |
| C | 形成的氧化物的种类最多 |
| D | 形成的化合物焰色反应呈黄色 |
| E | 生活中常用的金属,在空气中表面通常形成一层致密的氧化膜 |
| F | 最高价氧化物对应的水化物酸性在短周期中最强 |
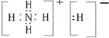 ,该物质能与水剧烈反应生成两种气体,实质发生水解反应生成氨气与氢气,反应的化学方程式:NH4H=NH3↑+H2↑;
,该物质能与水剧烈反应生成两种气体,实质发生水解反应生成氨气与氢气,反应的化学方程式:NH4H=NH3↑+H2↑;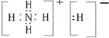 ;NH4H=NH3↑+H2↑;
;NH4H=NH3↑+H2↑;

科目:高中化学 来源: 题型:
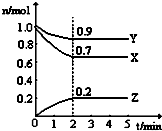 某温度时,在一个2L的密闭容器中,H2、N2、NH3三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,回答下列问题:
某温度时,在一个2L的密闭容器中,H2、N2、NH3三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
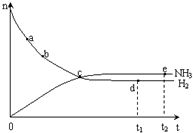 合成氨工业对国民经济和社会发展具有重要的意义. 合成塔中发生反应为:N2(g)+3H2(g)?2NH3(g)△H<0
合成氨工业对国民经济和社会发展具有重要的意义. 合成塔中发生反应为:N2(g)+3H2(g)?2NH3(g)△H<0| T/K | T1 | 573 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)已知下列两个热化学方程式:
(1)已知下列两个热化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:
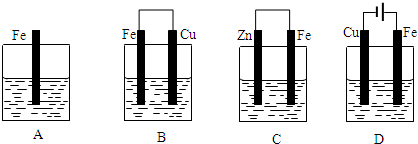
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
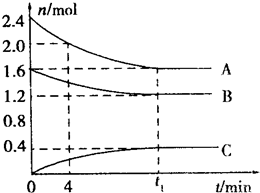 T℃时,在一容积为2L的容器中,A气体和B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示:
T℃时,在一容积为2L的容器中,A气体和B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
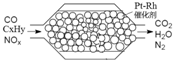
| A、产生22.4L氮气(标准状况)时,转移4x mol e- |
| B、上述过程中,NOx只被CO还原 |
| C、安装该净化器的汽车使用含铅汽油不会造成污染 |
| D、Pt-Rh催化剂可提高尾气的平衡转化率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com