
【题目】已知反应A2(g) + 2B2(g)![]() 2AB2(g) ΔH < 0,列说法正确的是 ( )
2AB2(g) ΔH < 0,列说法正确的是 ( )
A.升高温度,正向反应速率增加,逆向反应速率减小
B.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.升高温度有利于反应速率增加,从而缩短达到平衡的时间
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ实验室里需要纯净的氯化钠溶液,但实验室只有混有硫酸钠、碳酸氢铵的氯化钠.某学生设计了如下方案进行提纯:
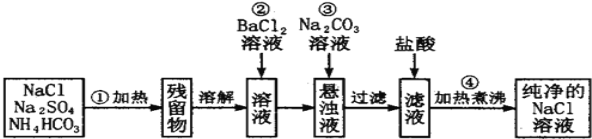
(1)操作②能否改为加硝酸钡溶液,______(填“能”或“否”) ,理由_____________________________。
(2)进行操作②后,如何判断SO42- 已除尽,方法是___________________。
(3)操作④的目的是_______________________________。
Ⅱ硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O为浅绿色晶体,实验室中常以废铁屑为原料来制备,其步骤如下:
步骤1 将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。
步骤2 向处理过的铁屑中加入过量的3mol/L H2SO4溶液,在60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液。
步骤3 向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)在步骤1中,分离操作,所用到的玻璃仪器有___________________________。(填仪器编号)
①漏斗 ②分液漏斗 ③烧杯 ④广口瓶 ⑤铁架台 ⑥玻璃棒 ⑦酒精灯
(2)在步骤3中,“一系列操作”依次为_____________________、_______________________和过滤。
(3)实验室欲用18mol/L H2SO4来配制240mL 3mol/L H2SO4溶液,需要量取________mL浓硫酸,实验时,下列操作会造成所配溶液浓度偏低的是__________________。(填字母)
a.容量瓶内壁附有水珠而未干燥处理 b.未冷却至室温直接转移至容量瓶中
c.加水时超过刻度线后又倒出 d.定容时仰视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明铁与稀硝酸反应产生一氧化氮,某校兴趣小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去)。B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;F为一个空的蒸馏烧瓶;E是用于鼓入空气的双连打气球。
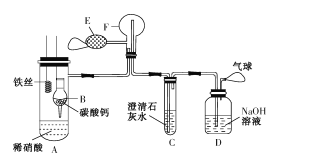
回答下列问题:
(l)实验时,先将B装置下移,使碳酸钙与稀硝酸接触产生气体,一段时间后,C中澄清石灰水____(填现象)时,将B装置上提,使之与稀硝酸分离。
(2)将A中铁丝放入稀硝酸中,装置A中产生________(填“无色”或“红棕色”)气体。用E向F中鼓入空气后,烧瓶F内发生反应的化学方程式为 ___, 一段时间后,C中的现象为____。
(3)若反应后向A中溶液滴加KSCN溶液,溶液不变红色,则铁丝与稀硝酸反应的离子方程式为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质一定属于同系物的是( )
①![]() ;②
;②![]() ;③
;③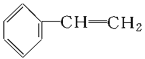 ;④C2H4;⑤CH2=CH-CH=CH2;⑥C3H6;⑦
;④C2H4;⑤CH2=CH-CH=CH2;⑥C3H6;⑦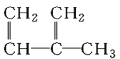 ;⑧
;⑧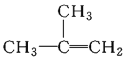
A.④和⑧B.①②和③C.⑦和⑧D.④⑥和⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为九种主族元素在周期表中的位置:
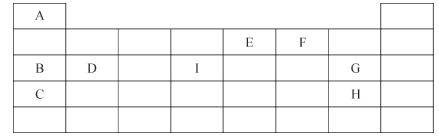
请回答下列问题:
(1)I元素的位置是第 ________周期,第______族。
(2)C、B、D 三种元素的金属性由强到弱的顺序为___________________(填元素符号)。
(3)E、F两种元素对应的最简单氢化物的稳定性:________________ (填化学式)。
(4)C的单质与稀盐酸反应的离子方程式为_________________________ 。
(5)G 的单质气体通入H、C形成化合物的水溶液中,写出该反应的化学方程式:______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:

下列说法错误的是:( )
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X + 3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.改变温度可以改变此反应的平衡常数
D.增大压强使平衡向生成Z的方向移动,平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeOCr2O3,还含有硅、铝等杂质。制备流程如图所示:
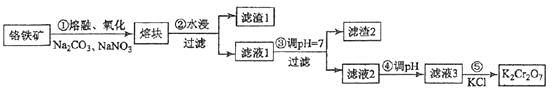
回答下列问题:
⑴步骤①的主要反应为:FeOCr2O3+Na2CO3+NaNO3![]() Na2CrO4 + Fe2O3 + CO2+ NaNO2
Na2CrO4 + Fe2O3 + CO2+ NaNO2
上述反应配平后FeOCr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是________________(可用化学方程式表示)。
⑵步骤④调滤液2的pH使之变_________(填“大”或“小”),原因是_________(用离子方程式表示)。
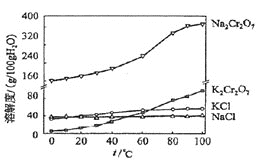
⑶有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到10℃得到的K2Cr2O7固体产品最多,步骤⑤的反应类型是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑酸钠(NaSbO3)具有广泛的应用,可用作显像管、光学玻璃和各种高级玻璃的澄清剂,纺织品、塑料制品的阻燃剂,搪瓷乳白剂,制造铸件用漆的不透明填料及铁皮、钢板抗酸漆的成分。工业上用双氧水氧化法制备NaSbO33H2O的工艺流程如下:
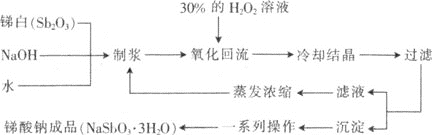
回答下列问题:
⑴NaSbO33H2O中Sb的化合价为________。
⑵先将锑白、氢氧化钠和水按一定的比例制浆,制浆过程中,搅拌、加热的目的是________。
⑶将制得的浆液加热至适当温度后,慢慢滴入30%的H2O2溶液进行氧化回流,温度不宜过高的原因是________。此过程中涉及反应如下,配平此化学方程式:
____Sb2O3 + ____H2O2 + ____NaOH + ____H2O = ____NaSbO33H2O。
⑷此流程中,可以循环利用的主要物质有________。
⑸“沉淀”主要成分为锑酸钠,流程中“一系列操作”主要包括________,产品在90~100℃下烘干,温度不宜太高的原因是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将一定量的A、B、C、D四种物质,置于密闭容器中发生如下反应:

mA(s)+nB(g)![]() pC(g)+qD(g)。达到平衡后,测得B的浓度为0.5mol/L。保持温度不变,将密闭容器的容积扩大到原来的两倍,再次达到平衡后,测得B的浓度为0.2mol/L,当其它条件不变时,C在反应混合物中的体积分数(x)与温度(T)、时间(t)的关系如图所示,下列叙述正确的是
pC(g)+qD(g)。达到平衡后,测得B的浓度为0.5mol/L。保持温度不变,将密闭容器的容积扩大到原来的两倍,再次达到平衡后,测得B的浓度为0.2mol/L,当其它条件不变时,C在反应混合物中的体积分数(x)与温度(T)、时间(t)的关系如图所示,下列叙述正确的是
A. 容积扩大到原来的两倍,平衡向逆反应方向移动
B. 化学方程式中n>p+q
C. 达到平衡后,若升高温度,平衡向逆反应方向移动
D. 达到平衡后,增加A的量,有利于提高B的转化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com