
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 0.5mol![]() 含中子数为8NA
含中子数为8NA
B. 常温下,1 mol NH4Cl含共价键数目为5NA
C. 足量的Cu与含溶质1mol的浓H2SO4反应,转移的电子数为NA
D. 11.2LH2和O2的混合气体中分子数目为0.5NA
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
(配制KMnO4标准溶液)
如图所示是配制50 mL KMnO4标准溶液的过程示意图。

(1)请你观察图示判断,其中不正确的操作有__________ (填序号)。
(2)其中确定50 mL溶液体积的容器是________(填名称)。
(3)如果用图示的操作配制溶液,所配制的溶液浓度将________(填“偏大”或“偏小”)。
(测定血液样品中Ca2+的浓度)
抽取血样20.00 mL,经过上述处理后得到草酸,再用0.020 mol·L-1 KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00 mL KMnO4溶液。
(4)配平草酸与KMnO4反应的离子方程式:__MnO+ H2C2O4+ H+=== Mn2++ CO2↑+ H2O。
(5)滴定终点时的现象是_____________________________________
(6)经过计算,血液样品中Ca2+的浓度为__________m mol·cm-3。
Ⅱ. 某小组同学设计如下实验,研究亚铁盐与H2O2溶液的反应。
实验1试剂:酸化的0.5 mol·L-1FeSO4溶液(pH = 0.2),5% H2O2溶液(pH = 5)。
操作 | 现象 |
取2 mL上述FeSO4溶液于试管中,加入5滴5% H2O2溶液 | 溶液立即变为棕黄色,稍后,产生气泡。测得反应后溶液pH=0.9 |
向反应后的溶液中加入KSCN溶液 | 溶液变红 |
(1)H2O2的电子式是_______,上述实验中H2O2溶液与FeSO4溶液反应的离子方程式是_________。
(2)产生气泡的原因是____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一只量程为25 mL的滴定管,若液面在8.0 mL处,将溶液全部放下来,液体的体积为( )
A.17.00 mLB.大于17.00 mLC.小于17.00 mLD.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国科学家合成了含有N5+的盐类,含有该离子的盐是高能爆炸物质,该离子的结构呈“V”形,如图所示。以下有关该物质的说法中不正确的是( )
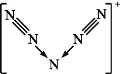
A. 每个N5+中含有35个质子和34个电子
B. 该离子中有非极性键和配位键
C. 该离子中含有4个π键
D. 与PCl4+互为等电子体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池结构如图所示,下列有关该原电池的说法不正确的是

A. 能将化学能转换成电能
B. 电子从铁棒经外电路流向碳棒,再经稀硫酸流向铁棒,形成闭合回路
C. 碳棒上发生还原反应
D. 总反应为Fe+H2SO4= FeSO4+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置或操作正确且能达到实验目的的是
A.制备氢氧化亚铁 | B.石油的蒸馏 | C.分离苯和水 | D.比较Fe、Cu的金属活动性 |
|
|
|
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是
A. 将饱和FeCl3溶液逐滴加到沸水中继续煮沸至液体呈红褐色,可制备Fe(OH)3胶体
B. 电解熔融的氯化铝,可制备铝单质
C. 加热使I2升华,可除去铁粉中的I2
D. 加入足量氨水,充分振荡、过滤,可除去硫酸铜溶液中的硫酸铝杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下图所示装置制备并检验Cl2的性质。下列说法正确的是 ( )

A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗
B.Ⅱ图中:充分光照后,量筒中剩余气体约10 mL(条件相同)
C.Ⅲ图中:生成蓝色的烟,若在集气瓶中加入少量水,溶液呈绿色
D.Ⅳ图中:干燥的有色布条不褪色,湿润的有色布条能褪色,说明Cl2有漂白性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com