
| A. | 钢铁发生吸氧腐蚀的正极反应式:Fe-2e-=Fe2+ | |
| B. | 碱性氢氧燃料电池的正极反应式:O2+2H2O+4e-=4OH- | |
| C. | 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+ | |
| D. | 用惰性电极电解饱和食盐水时,阴极的电极反应式为:2Cl--2e-=Cl2↑ |
分析 A.钢铁发生吸氧腐蚀时,正极上氧气得电子发生还原反应,负极上Fe失电子发生氧化反应;
B.碱性氢氧燃料电池中,正极上氧气得电子和水反应生成氢氧根离子,负极上氢气失电子和氢氧根离子反应生成水;
C.精炼粗铜时,粗铜与电源正极相连、纯铜与电源负极相连,阳极上Cu失电子、阴极上铜离子得电子;
D.用惰性电极电解饱和食盐水时,阴极上氢离子放电生成氢气,阳极上氯离子放电生成氯气.
解答 解:A.钢铁发生吸氧腐蚀时,正极上氧气得电子发生还原反应,负极上Fe失电子发生氧化反应,正极反应式为O2+2H2O+4e-=4OH-,负极反应式为Fe-2e-=Fe2+,故A错误;
B.碱性氢氧燃料电池中,正极上氧气得电子和水反应生成氢氧根离子,负极上氢气失电子和氢氧根离子反应生成水,负极反应式为2OH-+H2-2e-=2H2O,正极反应式为O2+2H2O+4e-=4OH-,故B正确;
C.精炼粗铜时,粗铜与电源正极相连、纯铜与电源负极相连,阳极上Cu失电子、阴极上铜离子得电子,阴极反应式为Cu2++2e-=Cu、阳极反应式为Cu-2e-=Cu2+,故C错误;
D.用惰性电极电解饱和食盐水时,阴极上氢离子放电生成氢气,阳极上氯离子放电生成氯气2H++2e-=H2↑,阴极反应式、阳极反应式为2Cl--2e-=Cl2↑,故D错误;
故选B.
点评 本题考查电极反应式的书写判断,为高频考点,明确各个电极上发生的反应是解本题关键,侧重考查学生分析判断能力,注意结合电解质溶液酸碱性书写.


科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | 只有①②③ | C. | 只有①③④ | D. | 除⑤外 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、B两种元素可组成化学式为BA2的化合物 | |
| B. | F与D形成的化合物性质很不活泼,不与任何酸反应 | |
| C. | 原子半径由大到小的顺序是E>F | |
| D. | 气态氢化物的稳定性由强到弱的顺序是C>D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al与NaOH溶液的反应:Al3++3OH-=Al (OH) 3↓ | |
| B. | CaCl2溶液与Na2CO3溶液反应:Ca2++CO32-=CaCO3↓ | |
| C. | MgSO4溶液与Ba(OH)2溶液反应:SO42-+Ba2+=BaSO4↓ | |
| D. | CaCO3与稀盐酸反应:CO32-+2 H+=H2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Ba2+、NO3-、CO32- | B. | Fe2+、Na+、SO42-、MnO4- | ||
| C. | K+、Mg2+、NO3-、SO42- | D. | Na+、Fe3+、Cl-、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ | B. | I2+SO2+2H2O=H2SO4+2HI | ||
| C. | H2O2+H2SO4=SO2+O2+2H2O | D. | 2Fe3++2I-=2Fe2++I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
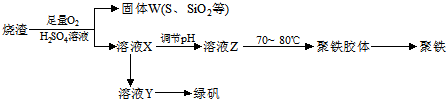
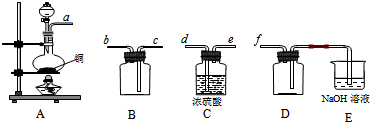
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com