
 和田玉因产于新疆和田而得名,以透闪石玉中的精品扬名于天下.透闪石玉又叫软
和田玉因产于新疆和田而得名,以透闪石玉中的精品扬名于天下.透闪石玉又叫软分析 (1)根据化合物中化合价为代数和为0计算x、y、m之间的关系,根据元素元素守恒可写出氧化物的形式;
(2)取少量透闪石玉样品粉末灼烧至恒重,则样品减少的质量即为氧化物形式中的水的质量,根据氧化物质的化学式进行计算;
(3)将样品看成氧化物的形式,加入足量稀盐酸充分溶解后,过滤、洗涤后得固体为二氧化硅为4.80g,根据二氧化硅的物质的量及样品的质量可确定样品的相对分子质量,样品粉末在空气中灼烧,样品减少的质量即为水的质量,据此确定化合物中水的量,根据x、y、m之间的关系,及相对分子质量列方程组可确定样品的化学式.
解答 解:(1)根据化合物中化合价为代数和为0可知,2x+2y+8×4+m-m-22×2=0,所以2x+2y-m=12,根据元素元素守恒可知,CaxMgySi8O22(OH)m表示成氧化物的形式为xCaO•yMgO•8SiO2•$\frac{m}{2}$H2O,
故答案为:2x+2y-m=12;xCaO•yMgO•8SiO2•$\frac{m}{2}$H2O;
(2)取少量透闪石玉样品粉末灼烧至恒重,则样品减少的质量即为氧化物形式中的水的质量,根据xCaO•yMgO•8SiO2•$\frac{m}{2}$H2O可知,减少的质量即水的质量与灼烧后固体中Si元素的质量比为($\frac{m}{2}$×18):(8×28)=9m:224,
故答案为:9m:224;
(3)将样品看成氧化物的形式,加入足量稀盐酸充分溶解后,过滤、洗涤后得固体为二氧化硅为4.80g即0.08mol,所以样品的相对分子质量为$\frac{8.10}{\frac{0.08}{8}}$=810,16.20g样品粉末即0.02mol,在空气中灼烧,根据图可知,生成水的质量为3.6g,即0.02mol,所以样品中水分子数为1即m=2,所以有$\left\{\begin{array}{l}{2x+2y-2=12}\\{40x+24y+28×8+16×22+17×2=810}\end{array}\right.$,解得x=2,y=5,所以样品的化学式为Ca2Mg5Si8O22(OH)2,
故答案为:Ca2Mg5Si8O22(OH)2.
点评 本题考查学生硅酸盐的有关知识以及根据题中所给的信息和元素守恒定律定律进行计算,推断物质的组成,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等 | |
| B. | 根据反应过程中是否有氧原子的得失,将化学反应分为氧化还原反应和非氧化还原反应 | |
| C. | 根据化合物在水溶液或熔融状态是否能导电,将化合物分为电解质和非电解质 | |
| D. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间 (s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/10-4mol/L | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/10-3mol/L | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
时间 浓度(mol?L-1) 温度 | 10min | 20min | 30min | 40min | 50min | 60min |
| 300℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
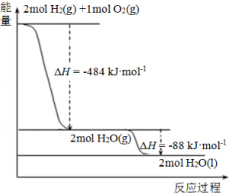
| A. | 926 kJ•mol-1 | B. | 485kJ•mol-1 | C. | 463 kJ•mol-1 | D. | 221 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
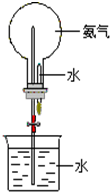 已知氨气与氯化氢气体都是极易溶于水的气体,在标准状况下1升水中最多能溶解500升的氯化氢气体,或者700升的氨气.
已知氨气与氯化氢气体都是极易溶于水的气体,在标准状况下1升水中最多能溶解500升的氯化氢气体,或者700升的氨气.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
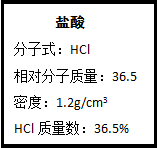 图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com