
【题目】草酸钴可用于指示剂和催化剂的制备。用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2等)制取CoC2O4·2H2O工艺流程如下:
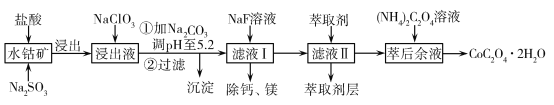
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②酸性条件下,ClO不会氧化Co2+,ClO转化为Cl-;③部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(1)浸出过程中加入Na2SO3的主要目的是________。
(2)向浸出液中加入NaClO3的离子反应方程式:________。
(3)已知:常温下NH3·H2O![]() NH4++OH- Kb=1.8×10-5
NH4++OH- Kb=1.8×10-5
H2C2O4![]() H++HC2O4- Ka1=5.4×10-2 HC2O4-
H++HC2O4- Ka1=5.4×10-2 HC2O4-![]() H++C2O42- Ka2=5.4×10-5
H++C2O42- Ka2=5.4×10-5
则该流程中所用(NH4)2C2O4溶液的pH________7(填“>”或“<”或“=”)。
(4)加入(NH4)2C2O4 溶液后析出晶体,再过滤、洗涤,洗涤时可选用的试剂有:________。
A.蒸馏水 B.自来水
C.饱和的(NH4)2C2O4溶液 D.稀盐酸
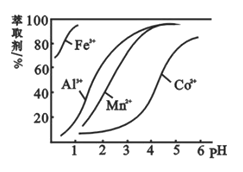
(5)萃取剂对金属离子的萃取率与pH的关系如图,萃取剂的作用是________;其使用的适宜pH范围是________。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
【答案】将Co3+、Fe3+还原为Co2+、Fe2+ ClO+6Fe2+ + 6H+=== Cl-+6Fe3++3H2O < A 除去溶液中的Mn2+ B
【解析】
含钴废料中加入盐酸和亚硫酸钠,可得CoCl2、AlCl3、FeCl2、MgCl2、CaCl2、MnCl2混合液;浸出液中加入NaClO3,可将FeCl2氧化为FeCl3,加入Na2CO3调溶液pH至5.2,由表格信息可知,AlCl3、FeCl3转化为Fe(OH)3、Al(OH)3沉淀而被除去;过滤后所得滤液I主要含有CoCl2、MgCl2、CaCl2、MnCl2,向溶液中加入NaF溶液,目的是除去钙、镁离子;过滤得到的滤液II中加入萃取剂除去溶液中的Mn2+,萃取后,萃取余液中加入草酸铵,过滤得到草酸钴晶体。
(1)亚硫酸钠具有还原性,能还原氧化性离子Fe3+、Co3+,所以浸出过程中加入Na2SO3的目的是将Fe3+、Co3+还原为Fe2+、Co2+。(2)NaClO3具有氧化性,能将浸出液中的Fe2+氧化成Fe3+,自身被还原生成氯离子,同时生成水,离子反应方程式为ClO3-+6Fe2++6H+=
6Fe3++Cl-+3H2O。(3)依据盐类水解可知,盐溶液的酸碱性取决于酸碱的强弱,谁强显谁性,由电离常数NH3H2ONH4++OH-Kb=1.8×10-5,HCO4-H++C2O42-Ka2=5.4×10-5可知,(NH4)2C2O4溶液中铵根离子水解大于草酸根离子水解,溶液呈酸性,即PH<7。(4)为洗涤晶体附着的离子,同时不引入新的杂质离子,过滤获得晶体洗涤时,可直接选用蒸馏水洗涤。(5)滤液中加入萃取剂的作用是除去锰离子;pH=2与pH=3时Co2+的萃取率变化不大,但pH=3时Mn的萃取率增大很多,而pH=5时,Co2+的萃取率比较大,损失严重,故pH=3时最佳。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+3B(g)![]() 2C(g)+2D(g) 在4种不同情况下反应速率分别如下,其中反应速率v最大的是
2C(g)+2D(g) 在4种不同情况下反应速率分别如下,其中反应速率v最大的是
A. v(A)=0.15mol/(L·min) B. v (B)=0.6 mol/(L·min)
C. v (C)=0.3 mol/(L·min) D. v (D)=0.1 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.控制变量法是化学实验的一种常用方法。下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
1 | 50.0 | 2.0 | 薄片 | 25 | 100 | m1 |
2 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m2 |
3 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m3 |
4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
5 | 50.0 | 6.0 | 粉末 | 35 | 30 | m5 |
6 | 50.0 | 8.0 | 粉末 | 25 | t6 | 16.1 |
7 | 50.0 | 10.0 | 粉末 | 25 | t7 | 16.1 |
(1)化学反应速率本质上是由物质的性质决定的,但外界条件也会影响反应速率的大小。本实验中实验2和实验3对比得出的结论是______________________________。
(2)我们最好选取实验________(填3个实验序号)研究锌的形状对反应速率的影响。
(3)若采用与实验1完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,发现反应速率明显加快。原因是______________________________。
(4)利用表中数据,可以求得:硫酸的物质的量浓度是________mol/L。
Ⅱ.某温度时,在5 L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题:
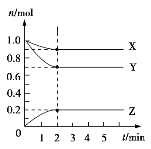
(5)反应开始至2 min,Y的平均反应速率______________________。
(6)分析有关数据,写出X、Y、Z的反应方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知溶液中:氧化性IO3—>I2>SO32-。向含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如右图所示,下列说法正确的是
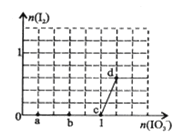
A. a点反应的还原剂是NaHSO3,被氧化的元素是碘元素
B. b点反应的离子方程式是:3HSO3-+IO3-+3OH-=3SO42-+I-+3H2O
C. c点到d点的反应中共转移0.6mol电子
D. 往200mL 1 mol/L的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式是:5 HSO3- + 2IO3- == I2+ 5SO42-+ 3H++ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期M、N两种元素对应的简单离子分别为mMa+、n Nb-,若离子的核外电子排布相同,则下列关系不正确的是( )
A. 原子半径:M < NB. 离子半径:M < N
C. 原子序数:M > ND. 主族序数:M < N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)NH3经一系列反应可以得到HNO3和NH4NO3,如图所示,

在Ⅰ中,NH3和O2在催化剂作用下反应,其化学方程式是:__________________________

(2)Ⅱ中,2NO(g)+ O2(g) 2NO2(g).在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线(如图).
①p1、p2的大小关系p1 ________ p2(填大于、等于、小于) .
②随温度升高,该反应平衡常数变化的趋势是_________________________
(3)Ⅲ中,降低温度,将NO2(g)转化为N2O4(1)再制备浓硝酸.
N2O4与O2, H2O化合的化学方程式是______________________________
(4)Ⅳ中,电解NO制备NH4NO3,其原理原理如下图所示,为使电解产物全部转化为NH4NO3, 需补充物质___________ ,说明理由:___________________.
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学进行如图所示实验,以检验化学反应中的能量变化。
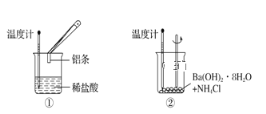
(1)实验发现,装置②中反应后溶液的温度________。
a.升高 b.降低 c.不变
(2)装置①中发生的反应,反应物的总能量比生成物的总能量_________。
a.高 b.低 c.相等
(3)已知断裂1 mol共价键需要吸收的能量分别为H-H:436kJ,I-I:151 kJ,H-I:299kJ。则反应H2+I2=2HI的能量变化为_______。
a.吸热 b.放热 c.无能量变化
(4)碱金属单质在空气中燃烧的产物与碱金属的活泼性有关。若某同学做了锂单质在空气中燃烧的实验,他得到的产物应为_____。(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图分别表示生物体内的生物大分子的部分结构模式图,据图回答:
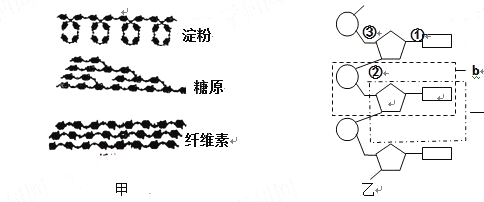
(1)甲图中的三种物质都是由许多 连接而成的,其中属于植物细胞中的储能物质是 。这三种物质中,在功能上与另外两种截然不同的是 ,这种物
质参与细胞中 的构成。
(2)乙图所示化合物的基本组成单位可用图中字母 表示,各基本单位之间是通过 (填①、②或③)连接起来的。
(3)由b形成的多聚体能储存大量的遗传信息,原因是 的排列方式是多样的。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓硫酸分别和三种钠盐反应,下列分析正确的是

A. 对比①和②可以说明还原性Br->Cl-
B. ①和③相比可说明氧化性Br2>SO2
C. ②中试管口白雾是HCl遇水蒸气所致,说明酸性H2SO4>HCl
D. ③中浓H2SO4被还原成SO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com