
| 分子式/结构式 | NO/N≡O | CO/C≡O | CO2/O=C=O | N2/N≡N |
| 化学键 | N≡O | C≡O | C=O | N≡N |
| 键能(KJ/mol) | 632 | 1072 | 750 | 946 |


分析 (1)①化学反应的焓变等于反应物旧键断裂吸收的能量和产物中新键生成释放的能量之差,据此回答计算;
②根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(2)温度相同时p1的一氧化氮的转化率大,所以增大压强平衡正向移动;α(NO)几乎为0的原因是无二氧化氮,NO2几乎完全分解;
(3)①因为决定2NO(g)+O2(g)?2NO2(g)速率的是反应②,所以反应①的活化能E1远小于反应②的活化能E2;决定反应速率的是反应②,而温度越高k2正增大,反应速率加快,二氧化二氮的浓度减少,导致两者的积减小;
②v2正升高到某一温度时v2正减小,平衡逆向移动,氧气的浓度增大,由此分析解答;
(4)根据图示得到温度和脱氮率的关系300℃之前,温度升高脱氮率逐渐增大;300℃之后,温度升高脱氮率逐渐减小,据此结合温度对平衡移动的影响知识来回答即可.
解答 解:(1)①化学反应的焓变等于反应物旧键断裂吸收的能量和产物中新键生成释放的能量之差,所以2NO(g)+2CO( g)?N2( g)+2CO2(g)的△H=(2×632+1072×2)-(750×4+946)kJ/mol=-538kJ/mol,
故答案为:-538;
②A.t1时正反应速率仍然在变化,说明没有达到平衡状态,故A错误;
B.平衡常数只受温度的影响,反应在恒温、恒容的密闭体系中进行,t1后,到达平衡,K始终不变,故B正确;
C.反应前后气体的系数和在变化,反应前后都为气体,质量不变,t1时$\frac{m总}{n总}$不变,到达平衡,故C正确;
D.反应前后气体的系数和在变化,所以总压不变的状态达到了平衡状态,故D正确;
故选A;
(2)温度相同时p1的一氧化氮的氮率大,所以增大压强平衡正向移动,所以p1>p2;800℃时,α(NO)几乎为0的原因是无二氧化氮,逆反应程度大,NO2几乎完全分解,
故答案为:大于;温度大于800℃时,逆反应程度大,NO2几乎完全分解;
(3)①因为决定2NO(g)+O2(g)?2NO2(g)速率的是反应②,所以反应①的活化能E1远小于反应②的活化能E2;决定反应速率的是反应②,而温度越高k2正增大,反应速率加快,二氧化二氮的浓度减少,导致两者的积减小;
故答案为:<;C;
②v2正升高到某一温度时v2正减小,平衡逆向移动,氧气的浓度增大,所以反应重新达到平衡,则变为相应的点为A,
故答案为:A;
(4)根据图示信息得到:300℃之前,温度升高脱氮率逐渐增大;300℃之后,温度升高脱氮率逐渐减小,这是因为:300℃之前,反应未平衡,反应向右进行,脱氮率增大;300℃时反应达平衡,后升温平衡逆向移动,脱氮率减小,
故答案为:300℃之前,温度升高脱氮率逐渐增大,而300℃之后,温度升高脱氮率逐渐减小;300℃之前,反应未平衡,反应向右进行,脱氮率增大;300℃时反应达平衡,后升温平衡逆向移动,脱氮率减小.
点评 本题考查了反应热的计算、化学平衡的影响因素,题目综合性较强,题目难度中等,侧重于考查学生的分析能力、以及对基础知识的综合应用能力,读图是解答关键.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
 某研究小组欲研究Fe2+的部分性质.
某研究小组欲研究Fe2+的部分性质.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | 电离平衡常数 |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||
 ,该化合物酸性条件下与高锰酸钾反应的离子方程式:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑
,该化合物酸性条件下与高锰酸钾反应的离子方程式:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )是以烃A为原料经过一系列反应合成的:
)是以烃A为原料经过一系列反应合成的:

 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaCl+2H2O.
+2NaCl+2H2O. +(2n-1)H2O.
+(2n-1)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上学期第三次调研化学试卷(解析版) 题型:实验题
KMnO4和MnO2都是重要化学物质,在实验室可以做氧化剂和催化剂,某学习小组对两种物质的制备和性质探究如下:
I.MnO2的制备:
该学习小组设计了将粗MnO2(含有较多的MnO、MnCO3和Fe2O3)样品转化为纯MnO2实验,其工艺流程如下:
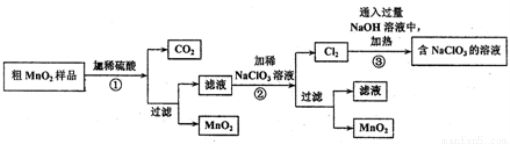
请回答下列问题:
(1)第①步操作中,生成CO2的化学方程式为____________。
(2)第②步操作中,NaClO3氧化MnSO4的离子方程式为_____________。
(3)第③步操作中,最终得到的固体除NaClO3外,还一定含有下列物质中的_________(填序号)。
a. NaCl b. NaClO c. NaClO4 d. NaOH
(4)为得到纯净的MnO2,须将过滤后的MnO2合并后进行洗涤。洗涤沉淀所用的玻璃仪器有:_____________,判断是否洗涤干净可选用的试剂是____________(填化学式)。
(5)NaClO3和MnO2在一定条件下都可以氧化浓盐酸制取氯气,制取等量的氯气消耗NaClO3与MnO2的物质的量之比为__________。
(6)工业上可以以石墨为电极电解酸化的硫酸锰制取二氧化锰,该过程的阳极反应式为___________。
II.KMnO4的制备和性质:
(7)实验室由二氧化锰制备高锰酸钾可分二步进行:
第一步:MnO2与KOH共熔并通入氧气:2MnO2+4KOH+O2=2K2MnO4+2H2O
第二步:通入CO2,可使K2MnO4发生歧化反应生成KMnO4和MnO2。
第二步完成反应时,转化为KMnO4的K2MnO4占其全部的百分率约为_______(精确到0.1%)
(8)该小组同学为了探究KMnO4溶液和Na2C2O4溶液的反应过程,将酸性KMnO4溶液逐滴滴入一定体积的Na2C2O4溶液中(温度相同,并不断振荡),记录的现象如下:

请将MnO4-氧化C2O42- 的离子方程式补充完整:
______MnO4-+C2O42-+_______=______Mn2++_____CO2↑+_______
请分析KMnO4溶液褪色时间变化的可能原因_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com