
【题目】下列事实:①NaHSO4溶液呈酸性;②长期使用化肥(NH4)2SO4会使土壤酸性增大,发生板结;③配制CuCl2溶液,用稀盐酸溶解CuCl2固体;④NaHS溶液中c(H2S)>c(S2-);⑤氯化铵溶液可去除金属制品表面的锈斑。其中与盐类的水解有关的叙述有( )
A.6项B.5项C.3项D.4项
科目:高中化学 来源: 题型:
【题目】金刚石和石墨都能燃烧,氧气不足时生成一氧化碳,充分燃烧生成二氧化碳,反应中放出的热量如图所示.下列说法正确的是 ( )

A. 金刚石和石墨互为同素异形体,它们之间的转化属于化学变化
B. 金刚石比石墨稳定
C. 相同物质的量的金刚石比石墨所含有的能量低
D. 由金刚石制取石墨放出1.9 kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质甲是一种重要的有机化工原料,其结构简式为![]() ,它一般不可能具有的性质是
,它一般不可能具有的性质是
A. 易溶于水,不易溶于有机溶剂
B. 在空气中燃烧产生黑烟
C. 能使溴的四氯化碳溶液褪色
D. 能发生加成反应在一定条件下可与4倍物质的量的氢气加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中一定量混合气体发生反应:2A(g)+B(g)![]() xC(g),达到平衡时测得A的浓度为0.5mol/L,在温度不变的条件下,将容器中的容积扩大到原来2倍,再达平衡时,测得A的浓度为0.3mol/L,下列有关判断正确的是
xC(g),达到平衡时测得A的浓度为0.5mol/L,在温度不变的条件下,将容器中的容积扩大到原来2倍,再达平衡时,测得A的浓度为0.3mol/L,下列有关判断正确的是
A. x=3 B. 平衡向正反应方向移动
C. B的转化率降低 D. C的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列常用物质:
A.碳酸氢钠 B.阿斯匹林 C.葡萄糖 D.苯甲酸钠 E.柠檬黄
请用字母填空:
①具有解热镇痛疗效的是________,②可直接进入人体血液补充能量的是________,③可用作食品防腐剂的是________,④常用作食品着色剂的是________,⑤常用作治疗胃酸过多的抗酸剂的是________。
(2)保护环境,人人有责。
①空气质量监测中,不需要监测的指标是_________。
A.可吸入颗粒物的含量 B.NO2浓度 C.SO2浓度 D.CO2浓度
②在处理产生的废水时,需先加入明矾,其作用是____________;后通入氯气或二氧化氯,其作用是______________。
③对垃圾需要分类处理。如图所示的垃圾分类标志的含义是___________。

(3)化学与材料密切关联。
①石墨烯(如图)可用作太阳能电池的电极,这里主要利用了石墨烯的________性。

②钢铁在酸雨中会发生电化学腐蚀,请举一例钢铁防腐措施____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关平衡常数的说法正确的是( )
A.已知K=![]() ,则对应的化学反应可以表示为:2CO2(g) + 6H2(g)
,则对应的化学反应可以表示为:2CO2(g) + 6H2(g)![]() CH3CH2OH(g)+3H2O(g)
CH3CH2OH(g)+3H2O(g)
B.化学平衡常数K与温度有关,随温度的升高,K可能增大也可能减小
C.常温下,向纯水中加入碳酸钠,水的电离程度变大,Kw变大
D.将某浓度氢氟酸溶液升高温度,氢氟酸的电离平衡常数Ka将变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. 无色透明溶液中:Ca2+、Cu2+、Br-、Cl-
B. 能使酚酞变红的溶液中:K+、Na+、CO![]() 、AlO2-
、AlO2-
C. c(ClO-)=1mol·L-1的溶液中:Fe2+、Al3+、NO3-、I-
D. 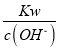 =0.1mol·L-1的溶液中:NH4+、Mg2+、SO42-、CH3COO-
=0.1mol·L-1的溶液中:NH4+、Mg2+、SO42-、CH3COO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.部分弱酸的电离平衡常数如表:
弱酸 | HCOOH | HNO2 | H2S | H2SO3 | H2C2O4 | H2CO3 |
电离平衡常数(25℃) | K=1.8×10-4 | K=5.1×10-4 | K1=9.1×10-8 K2=1.1×10-12 | K1=1.23×10-2 K2=6.6×10-8 | K1=5.4×10-2 K2=5.4×10-5 | K1=4.3×10-7 K2=5.6×10-11 |
(1)上表的6种酸进行比较,酸性最弱的是:___;HCOO-、S2-、HSO3-3种离子中,最难结合H+的是___。
II.已知在室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,回答下列问题:
(1)两溶液中c(H+)·c(OH-)=___。
(2)各取5mL上述溶液,分别加水稀释至50mL,pH较大的是__溶液。
(3)各取5mL上述溶液,分别加热到90℃,pH较小的是___溶液。
(4)两溶液中由水电离出的c(H+)分别为:H2SO4溶液___;NH4Cl溶液__。
(5)取5mLNH4Cl溶液,加水稀释至50mL,c(H+)___10-6mol·L-1(填“>”、“<”或“=”),![]() __(填“增大”、“减小”或“不变”)
__(填“增大”、“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,有关物质的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数K | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)以上三种电解质的酸性由强至弱顺序为__________________(用化学式表示,下同)。
(2)常温下,0.02 mol·L-1的CH3COOH溶液的电离度约为______,体积为10mLpH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者________后者(填“>、<或=”)。
(3)已知NaHSO3溶液显酸性,其原因是____________(离子方程式配适当文字叙述)。
(4)H2SO3溶液和NaHCO3溶液反应的主要离子方程式为_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com