
分析 (1)4NH3+5O2$\stackrel{催化剂、△}{→}$4NO+6H2O①与4NO+3O2+2H2O→4HNO3②相加得到4NH3+8O2=4HNO3+4H2O,据此计算硝酸的质量分数;
(2)质量转化为物质的量,依据NH3~HNO3,计算硝酸的物质的量,依据V=$\frac{m}{V}$计算硝酸溶液的密度,依据公式C=$\frac{n}{V}$计算硝酸的物质的量浓度;
(3)铁与浓硝酸反应生成二氧化氮,与稀硝酸反应生成一氧化氮,当硝酸足量时,反应只生成硝酸铁,硝酸不足量时生成硝酸亚铁,依据生成的一氧化氮、二氧化氮的物质的量,消耗铁的物质的量,利用原子个数守恒、得失电子数守恒计算解答;
(4)①设混合气体中含有xmolNO,ymolNO2,依据题干条件n(NO):n(NO2)=9:1,及总质量为3160mg,计算两种气体的物质的量,
氢氧化钠与一氧化氮气体、二氧化氮混合气体反应,方程式为:NO+NO2+2NaOH=2NaNO2+H2O,反应后剩余气体为一氧化氮,将剩余其一般氧化为二氧化氮,依据得失电子守恒计算氧化一氧化氮用的氧气的体积,依据富氧空气中氧气的含量计算需要富氧空气的体积;
②依据得失电子守恒可知NO、NO2中氮原子变为氮气中0价的N 得到电子总数等于NH3中-3价的N变为氮气中0价的N失去电子总数,据此解答.
解答 解:(1)4NH3+5O2$\stackrel{催化剂、△}{→}$4NO+6H2O①与4NO+3O2+2H2O→4HNO3②相加得到4NH3+8O2=4HNO3+4H2O,所以硝酸的质量分数为:$\frac{4×63}{4×63+4×18}$=0.78;
故答案为:0.78;
(2)1.70吨液氨的物质的量为:$\frac{1.7×1{0}^{6}}{17}$=0.1×106mol,依据转化关系4NH3+8O2=4HNO3+4H2O,可知生成的硝酸的物质的量为0.1×106mol;消耗氧气的物质的量为:0.2×106mol;依据方程式4NH3+8O2=4HNO3+4H2O,可知硝酸溶液的质量=液氨的质量+水的质量+消耗氧气的质量=1.70×106+4.50×106+×32×0.2×106=12.6×106(g)
该硝酸溶液的体积V=$\frac{m}{ρ}$=$\frac{12.6×1{0}^{6}}{1.31×1{0}^{3}}$=9.62×103(L),则C(HNO3)=$\frac{n}{V}$=$\frac{0.1×1{0}^{6}}{9.62×1{0}^{3}}$=10.40(mol/L);
故答案为:10.40;
(3)铁与浓硝酸反应生成二氧化氮,与稀硝酸反应生成一氧化氮,当硝酸足量时,反应只生成硝酸铁,硝酸不足量时生成硝酸亚铁,设最后溶液中含有硝酸铁物质的量为xmol,硝酸亚铁的物质的量为ymol,
则已经得失电子守恒可知铁生成三价铁和二价铁离子失去电子总数等于硝酸还原为二氧化氮和一氧化氮得到电子总数即:3x+2y=0.30mol×(5-4)+0.20mol×(5-2);
依据铁原子个数守恒可知:x+y=$\frac{22.4}{56}$;
解方程组:3x+2y=0.30mol×(5-4)+0.20mol×(5-2);
x+y=$\frac{22.4}{56}$;
得x=0.1mol,y=0.3mol;
所以最后溶液中含有硝酸铁,物质的量为0.1mol;含有硝酸亚铁,物质的量为0.3mol;
故答案为:Fe(NO3)2 0.3mol、Fe(NO3)30.1mol;
(4)①由题意可知:n(NO):n(NO2)=9:1,及总质量为3160mg,设设混合气体中含有xmolNO,ymolNO2,
则:x:y=9:1;
30x+46y=3.16;
解得x=0.09;y=0.01;
与一氧化氮气体、二氧化氮混合气体反应,方程式为:NO+NO2+2NaOH=2NaNO2+H2O,
1 1
0.01mol 0.01mol
剩余NO物质的量为0.09mol-0.01mol=0.08mol,要想完全被吸收,则只需要用氧气氧化0.04molNO生成0.04mol二氧化氮,依据得失电子守恒得:0.04mol
×(4-2)=n(O2)×4,解得n(O2)=0.02mol,标况下体积为:0.02mol×22.4L/mol=0.448L,
而富氧空气中O2的体积分数为0.25,所以需要富氧空气的体积为:0.448L÷0,25=1.792L;
故答案为:1.792L;
②由①知1m3硝酸工业的尾气中含3160mg NOx,含有NO0.09mol,含有NO20.01mol,如果用氨催化还原法,即用氨作催化剂,将NO、NO2转化为氮气直接排入空气中,设需要氨气的物质的量为:n(NH3)则依据得失电子守恒可知:0.09mol×(2-0)+0.01mol×(4-0)=n(NH3)×(0-(-3)),
解得n(NH3)=$\frac{0.22}{3}$(mol)
其质量为:$\frac{0.22}{3}$mol×17g/mol=1.25g;
故答案为:1.25.
点评 本题考查了有关方程式的计算,明确方程式中各物质的物质的量的关系及物质的性质是解题关键,注意原子个数、得失电子数守恒规律的应用,题目难度较大.


 英才计划期末调研系列答案
英才计划期末调研系列答案 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
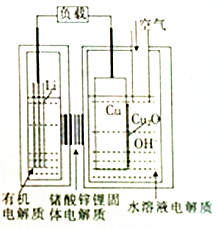 近年来AIST报告正在研究一种“高容量、低成本”锂-铜空气燃料电池.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是( )
近年来AIST报告正在研究一种“高容量、低成本”锂-铜空气燃料电池.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是( )| A. | 放电时,Li+透过固体电解质向Cu极移动 | |
| B. | 放电时,负极的电极反应式为Cu2O+H2O+2e-=Cu+2OH- | |
| C. | 通空气时,铜被腐蚀,表面产生Cu2O | |
| D. | 整个反应过程中,铜相当于催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焰色反应实验中,铂丝在蘸取待测溶液前,应先用稀H2SO4洗净并灼烧 | |
| B. | 制备氢氧化铜悬浊液时,向10%NaOH溶液中滴入少量2%CuSO4溶液 | |
| C. | 配制浓H2SO4、浓HNO3混合酸时,首先向试管里放入一定量浓H2SO4 | |
| D. | 纸层析实验中,将试液点滴浸没在展开剂里,静置观察 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | H2S+2NO3-+2H+=2NO2↑+S↓+2H2O | |
| B. | 3 H2S+2NO3-+2H+=2NO↑+3S↓+4H2O | |
| C. | 3Fe3++3NO3-+6H2S=3NO↑+6S↓+3Fe2++6H2O | |
| D. | Fe3++3NO3-+5H2S+2H+=3NO↑+5S↓+Fe2++6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向l0mL0.1mol•L-1FeI,溶液中缓缓通人标准状况下11.2mL Cl2 | |
| B. | 向AlCl3溶液中滴加Na2S溶液 | |
| C. | 向含有Na+、Fe2+、Cl-、SO42-离子的溶液中通入NO2 | |
| D. | 向5mL0.1 mol•L-1NaOH溶液中,逐滴加入1 mL0.1 mol•L-1AlCl3溶液,边滴加边振荡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | L | Z |
| Y | W |
| A. | Y的原子半径一定比L的大 | |
| B. | 若 X、Y为非金属元素,则X、Y元素形成的单质晶体类型一定相同 | |
| C. | 若X、W能组成XW2型分子,则其空间构型一定为直线型 | |
| D. | 对应简单氢化物的沸点可能是 X>Y、Z>W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 环丙烷的结构简式可表示为△,而环已烷由于各个原子在空间的排列方式不同,有下列两种空间异构体.据此判断,当环已烷的不同碳原子上连有两个甲基(-CH3)时,包括甲基在六碳环上位置的不同和空间异构体在内,共有异构体的数目是( )
环丙烷的结构简式可表示为△,而环已烷由于各个原子在空间的排列方式不同,有下列两种空间异构体.据此判断,当环已烷的不同碳原子上连有两个甲基(-CH3)时,包括甲基在六碳环上位置的不同和空间异构体在内,共有异构体的数目是( )| A. | 6种 | B. | 12种 | C. | 14种 | D. | 18种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性:A>B>C | B. | 原子序数:A<B<C | ||
| C. | 原子半径:A<B<C | D. | 单质与氢气的化合能力:A>B>C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com