
【题目】黄钾铵铁矾[KNH4Fex(SO4)y(OH)z]不溶于水和稀硫酸,制取黄钾铵铁矾的示意图如下:
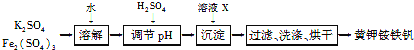
(1)溶液X是________。
(2)检验滤液中是否存在K+的操作是________________________。
(3)黄钾铵铁矾的化学式可通过下列实验测定:
①称取一定质量的样品加入稀硝酸充分溶解,将所得溶液转移至容量瓶并配制成100.00 mL溶液A。
②量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体9.32 g。
③量取25.00 mL溶液A,加入足量NaOH溶液,加热,收集到标准状况下气体224 mL,同时有红褐色沉淀生成。
④将步骤③所得沉淀过滤、洗涤、灼烧,最终得固体4.80 g,则黄钾铵铁矾的化学式为______________。
【答案】氨水(或NH3·H2O) 用洁净的铂丝(或铁丝)蘸取滤液在酒精灯火焰上灼烧,透过蓝色的钴玻璃观察,若火焰呈紫色,则存在K+ KNH4Fe6(SO4)4(OH)12
【解析】
(1)由制取黄钾铵铁矾的流程图及黄钾铵铁矾[KNH4Fex(SO4)y(OH)z]的组成可知,加入X是氨水,以便生成黄钾铵铁矾;
(2)通过焰色反应检验钾离子的存在情况,方法为:用洁净的铂丝(或铁丝)蘸取滤液在酒精灯火焰上灼烧,透过蓝色的钴玻璃观察,若火焰呈紫色,则存在K+;
(3)②的沉淀为硫酸钡,硫酸钡的物质的量等于溶液中硫酸根的物质的量:n(SO42-)=n(BaSO4)=![]() =0.04 mol;
=0.04 mol;
③所得气体为氨气,溶液中铵根离子物质的量等于氨气的物质的量:n(NH4+)=n(NH3)=![]() =0.01 mol;
=0.01 mol;
④最终得到的固体是氧化铁,根据铁原子守恒,溶液中的铁离子物质的量为:n(Fe3+)=2n(Fe2O3)=2×![]() =0.06 mol,黄钾铵铁矾[KNH4Fex(SO4)y(OH)z]中,n(K+)=n(NH4+)=0.01mol,根据电荷守恒:n(OH-)=n(K+)+n(NH4+)+3n(Fe3+)-2n(SO42-)=0.12 mol,n(K+):n(NH4+):n(Fe3+):n(SO42-):n(OH-)=1:1:6:4:12,黄钾铵铁矾的化学式为KNH4Fe6(SO4)4(OH)12。
=0.06 mol,黄钾铵铁矾[KNH4Fex(SO4)y(OH)z]中,n(K+)=n(NH4+)=0.01mol,根据电荷守恒:n(OH-)=n(K+)+n(NH4+)+3n(Fe3+)-2n(SO42-)=0.12 mol,n(K+):n(NH4+):n(Fe3+):n(SO42-):n(OH-)=1:1:6:4:12,黄钾铵铁矾的化学式为KNH4Fe6(SO4)4(OH)12。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如下:

试回答下列问题:
(1)请写出C装置中生成CH3Cl的化学方程式:___________________________________。有人认为E中有氯化氢产生,不能证明甲烷与氯气发生了取代反应,你认为他的看法________(填“正确”或“不正确”)。
(2)B装置有三种功能:①控制气流速率;②混匀混合气体;③________________。
(3)一段时间后发现D装置中的棉花由白色变为蓝色,则棉花上可能预先滴有________溶液。
(4)E装置中除盐酸外,还含有机物,从E中分离出盐酸的最佳方法为________(填字母)。
a.分液法 b.蒸馏法 c.结晶法
(5)将1 mol CH4与Cl2发生取代反应,充分反应后生成的CH3Cl、CH2Cl2、CHCl3、CCl4四种有机产物的物质的量依次增大0.1 mol,则参加反应的Cl2的物质的量为________,生成HCl的总物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组制备氢氧化亚铁沉淀。
实验1 |
| 实验现象 |
液面上方产生白色絮状沉淀,迅速变为灰绿色,振荡,试管壁上有红褐色沉淀生成。 |
(1)实验1中产生白色沉淀的离子方程式是_______。
(2)为了探究沉淀变灰绿色的原因,该小组同学展开如下探究:
①甲同学推测灰绿色物质为Fe(OH)2和Fe(OH)3混合物。查阅资料后根据调色原理认为白色和红褐色的调和色不可能是灰绿色,并设计实验证实灰绿色物质中不含有Fe(OH)3,方案是______。
②乙同学查阅文献:Fe(OH)2在大量SO42-存在的情况下形成Fe6(SO4)2(OH)4O3(一种灰绿色氧基碱式复盐)。并设计对比实验证实该假设:向试管中加入________,再往试管中加入_________,振荡,现象与实验1相同,结论是该假设不成立。
③乙同学继续查阅文献:Fe(OH)2沉淀具有较强的吸附性能,灰绿色可能是由Fe(OH)2表面吸附Fe2+引起。推测所用的硫酸亚铁溶液的浓度应越小越好;氢氧化钠溶液浓度应越大越好。设计了如下实验方案:
试管中10mLNaOH溶液 | 滴加FeSO4溶液 | 实验现象 | |
实验2 | 6 mol/LNaOH溶液 | 0.2mol/L FeSO4溶液 | 产生悬浮于液面的白色沉淀(带有少量灰绿色),沉淀下沉后,大部分灰绿色变为白色沉淀 |
实验3 | 6 mol/LNaOH溶液 | 0.1mol/L FeSO4溶液 | 产生悬浮于液面的白色沉淀(带有极少量灰绿色),沉淀下沉后,底部都为白色沉淀 |
该实验得出的结论是________。丙同学认为该实验方案不足以证明灰绿色是由Fe(OH)2表面吸附Fe2+引起的,还需补充的实验是__________,证明该假设成立。
(3)根据以上实验探究,若尽可能制得白色Fe(OH)2沉淀,需要控制的实验条件_____。
(4)下列情况会导致所配NaOH溶液的浓度偏高的是_______。
A.NaOH溶液未冷却至室温就进行定容 B.配制前容量瓶中有少量的水
C.配制溶液时,俯视容量瓶刻度线 D.加水时超过刻度线,用胶头滴管吸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业的原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:
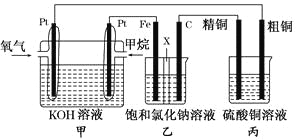
(1)甲烷燃料电池负极反应式为________________________。
(2)石墨(C)极的电极反应式为_______________________。
(3)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁极上生成的气体的体积为________L;丙装置中阴极析出铜的质量为________ g。
(4)某同学利用甲烷燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图所示)。
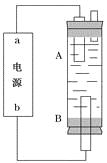
若用于制漂白液,a为电池的________极,电解质溶液最好用)________________
若用于制Fe(OH)2,使用硫酸钠溶液作电解质溶液,阳极选用________作电极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作,现象和结论都正确的是
选项 | 操作 | 现象 | 结论 |
A | 用坩埚钳夹一块铝箔在酒精灯上灼烧 | 铝箔熔化并滴落 | 氧化铝的熔点较低 |
B | 向亚硫酸钠溶液中滴加足量盐酸,将产生的气体通入品红溶液 | 品红溶液褪色 | 非金属性: |
C | 将用砂纸除去保护膜的镁片和铝片(大小、形状相同),分别插入同浓度的稀硫酸中 | 镁片表面产生气泡速率大于铝片 | 还原性: |
D | 常温下,将两根大小相同的铁钉分别插入浓硝酸和稀硝酸中 | 浓硝酸中无明显现象,稀硝酸中产生气泡 | 稀硝酸的氧化性比浓硝酸强 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物Ⅰ是有机合成中间体,如可合成J或高聚物等,其合成J的线路图如图:

已知:①![]() ,A苯环上的一氯代物只有2种
,A苯环上的一氯代物只有2种
②有机物B是最简单的单烯烃,J为含有3个六元环的酯类
③![]()
![]() (
(![]() 、
、![]() 为烃基或H原子)
为烃基或H原子)
回答以下问题:
(1)A的化学名称为_____;E的化学式为_____。
(2)![]() 的反应类型:____;H分子中官能团的名称是____。
的反应类型:____;H分子中官能团的名称是____。
(3)J的结构简式为____。
(4)写出I在一定条件下生成高聚物的化学反应方程式____。
(5)有机物K是G的一种同系物,相对分子质量比G少14,则符合下列条件的K的同分异构体有___种(不考虑立体异构)。
a.苯环上只有两个取代基
b.既能发生银镜反应也能与![]() 溶液反应
溶液反应
写出其中核磁共振氢谱有6个峰,峰面积之比为2:2:1:1:1:1的结构简式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下,Ksp(NiS)≈1.0×10-21,Ksp(ZnS)≈1.0×10-25,pM=-lgc(M2+)。向20mL0.1mol·L-1NiCl2溶液中滴加0.1mol·L-1Na2S溶液,溶液中pM与Na2S溶液体积的关系如图所示,下列说法正确的是( )
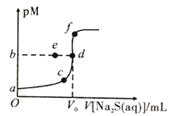
A.图像中,V0=40,b=10.5
B.若NiCl2(aq)变为0.2mol·L-1,则b点向a点迁移
C.若用同浓度ZnCl2溶液替代NiCl2溶液,则d点向f点迁移
D.Na2S溶液中存在c(OH-)=c(H+)+c(HS-)+c(H2S)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语书写正确且能合理解释事实的是 ( )
A.由H和Cl形成共价键的过程:![]()
B.用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O
C.向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间后,溶液变蓝:4H+ +4I- +O2=2I2 +2H2O
D.向含0.1 mol FeBr2的溶液中通入0.1 mol Cl2:2Fe2++4Br-+3C12=2Fe3++2Br2+6C1-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是某学生自己总结的一些规律,其中正确的是( )
A. 氧化物不可能是还原产物,只可能是氧化产物
B. 一种元素可能有多种氧化物,但同种化合价只对应一种氧化物
C. 饱和溶液一定比不饱和溶液的浓度大
D. 有些化学反应不属于化合、分解、置换、复分解等类型中的任何一种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com