
(12分)【化学-有机化学基础】化合物E常用于制备抗凝血药,可以通过如图所示路线合成。

(1)检验A中官能团的试剂为________,B中含氧官能团的名称是________。
(2) l mol E最多可与__________mol H2发生加成反应。
(3)写出D与足量NaOH溶液完全反应的化学方程式____________________。
(4)B有多种同分异构体,写出同时满足下列条件的一种同分异构体的结构简式
A.能发生银镜反应
B.核磁共振氢谱只有4个峰
C.能与FeCl3溶液发生显色反应,水解时1 mol可消耗3 mol NaOH
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014-2015学年四川省成都市第三次诊断化学试卷(解析版) 题型:选择题
如图为元素周期表的一部分,W、X、Y、Z均为短周期主族元素。下列分析—定正确的是
W | X | |
Y | Z |
A.Y的气态氢化物最稳定
B.Z的单核阴离子还原性最强
C.x单质常温下化学性质活泼
D.Y的原子序数比W大7
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省西安市高三下学期一模理综化学试卷(解析版) 题型:选择题
根据下列实验内容得出的结论正确的是
选项 | 实验内容 | 结论 |
A | 某物质的水溶液使红色石蕊试纸变蓝 | 该物质一定是碱 |
B | 某气体能使湿润淀粉碘化钾试纸变蓝 | 该气体一定是氯气 |
C | 某物质的水溶液中加入盐酸产生无色无味气体 | 该溶液一定含有碳酸根离子 |
D | 0.84g铁和50.00mL 1.00mol/L的稀硝酸反应 | 反应后溶液中一定有Fe3+和Fe2+ |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东师大附中高三第七次模拟考试理综化学试卷(解析版) 题型:选择题
化学与社会、生活密切相关。对下列现象或事实的解释正确的是
选项 | 现象或事实 | 解释 |
A | 用活性炭去除冰箱中的异味 | 发生了化学变化 |
B | 漂白粉在空气中久置变质 | 漂白粉中的CaCl2 与空气中的CO2反应生成CaCO3 |
C | 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用 | K2CO3与NH4Cl反应生成氨气会降低肥效 |
D | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | 没有发生氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省枣庄市高三4月模拟考试化学试卷(解析版) 题型:选择题
(1)已知t ℃时AgCl的Ksp=2×10-10 ;(2)在t ℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
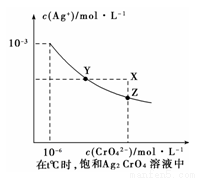
A.在t ℃时,Ag2CrO4的Ksp为1×10-9
B.在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点
C.在t ℃时,以0.01 mol/L AgNO3溶液滴定20 mL0.01 mol/L KCl和0.01 mol/L的K2CrO4的混和溶液,Cl-先沉淀
D.在t ℃时,AgCl的溶解度大于Ag2CrO4
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三4月过程性检测理综化学试卷(解析版) 题型:选择题
饱和氯水中存在平衡:①C12+H2O H++Cl—+HClO,②HClO
H++Cl—+HClO,②HClO H++ClO—,取饱和氯水分别进行下列实验,相应结论错误的是
H++ClO—,取饱和氯水分别进行下列实验,相应结论错误的是
A.逐滴加入氨水中,所得溶液中c(H+)逐渐增大
B.继续通入过量C12,①、②均向右移动,溶液pH减小
C.加入CaCO3悬浊液中,CaCO3的溶解平衡向右移动
D.加入一定量NaOH溶液中,所得溶液中离子浓度的关系可能为c(Cl-)+ c(ClO-)= c(Na+)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏银川一中高三第二次模拟考试 理综化学试卷(解析版) 题型:推断题
【化学——选修有机化学基础】(15分)
已知:
①
②C物质苯环上一卤代物只有两种。

根据上述转化关系,回答问题:
(1)写出B物质的名称 ;D物质的结构简式 。
(2)写出反应②的类型 ;反应⑤的条件 。
(3)写出反应⑥的化学方程式: 。
(4)写出E和D反应的化学方程式: 。
(5)反应②还有可能生成一种C16H18的有机物,其苯环上一卤代物也只有两种,写出它的结构简式: 。
(6)分子中具有苯环,苯环上含有两个取代基,且能与NaHCO3溶液反应的E的同分异构体有_______种(不包含E)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省高三上学期第五次模拟考试理综化学试卷(解析版) 题型:简答题
(14分)铜及其化合物在工业、农业、科技和日常生活中有广泛应用。
(1)工业上利用辉铜矿(主要成分是Cu2S)冶炼铜。为了测定辉铜矿样品的纯度,用酸性高锰酸钾溶液反应,所得溶液加入Ba(NO3)2有白色沉淀生成。写出辉铜矿与高锰酸钾反应的离子方程式 。
(2)工业上利用废铜屑、废酸(含硝酸、硫酸)为主要原料制备硫酸铜晶体。某含有c(HNO3)=2 mol/L,c(H2SO4)=4 mol/L的废酸混合液100 mL(不使用其它酸或氧化剂),最多能制备硫酸铜晶体(CuSO4·5H2O)的质量为 〔M(CuSO4·5H2O)=250〕.
(3)现有一块含有铜绿〔Cu2(OH)2CO3〕的铜片(假设不含其它杂质)在空气中灼烧至完全反应,经测定,反应前后固体的质量相同。
①固态铜与适量氧气反应,能量变化如下图所示,写出固态铜与氧气反应生成1 mol固态氧化亚铜的热化学方程式 。

②上述铜片中铜的生锈率为 (金属生锈率= )。(结果保留到整数)
)。(结果保留到整数)
(4)自然界中各种原生铜的硫化物经氧化、淋滤作用后转化为硫酸铜溶液,并向深部渗透,遇到深层的闪锌矿(ZnS)和方铅矿(PbS),慢慢地转变为铜蓝(CuS)。
①硫化铜与氧气在淋滤作用下生成硫酸铜等,该过程的化学方程式为 。
②写出渗透到地下深层的硫酸铜溶液遇到闪锌矿发生反应的离子方程式 ,请用简短的语言解释该反应发生的原理 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省等高三下学期期中四校联考化学试卷(解析版) 题型:选择题
某研究小组提出了一种新的设想:利用原电池原理,设计一种H2、Cl2燃料电池,原电池总反应为:H2+Cl2=2HCl,在对外提供电能的同时还可得到工业上具有重要用途的较浓的盐酸。他们设计的原电池装置如下,其中两个电极均为多孔铂电极。下列有关叙述不正确的是

A.a为负极,通入的气体为氢气
B.正极的电极反应式为:Cl2+2e-=2Cl-
C.电流由b极流出,经外电路到a极
D.原电池内部,H+移向负极,Cl-移向正极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com